On sait l’importance de cet élément dans l’organisme humain où l’iode contribue à la synthèse des hormones thyroïdiennes qui jouent un rôle crucial dans le développement et la maturation du système nerveux ainsi que dans la régulation du métabolisme de nombreux tissus. Il en va de même des espèces marines et plus encore, des équilibres au sein des océans. Ses particularités chimiques, son impact biologique sur les écosystèmes et la biodiversité, son intérêt dans un aquarium marin et récifal, comment mesurer iodures et iodates, comment interpréter les bioindicateurs d’excès et de carence, comment le diminuer ou l’augmenter… autant d’aspects que cet article propose de développer.
Peu présent sur la planète il contribue largement à la vie. Sa répartition est très inégale sur Terre, présent dans les sols à concentrations très variables d’une région à l’autre. Les plantes absorbent l’iode du sol et de l’eau. De faibles quantités sont présentes dans l’air sous forme d’aérosols iodé, mais c’est dans les océans qu’il est le plus présent.
1. L’iode dans les océans
L’eau de mer contient en moyenne 60 µg/l (0,06 mg/l) d’iode élémentaire I. Libéré dans l’eau de mer par des processus géologiques et atmosphériques, l’iode participe à diverses réactions chimiques contribuant à des processus plus globaux dans les océans. Il joue ainsi un rôle dans le maintien de l’équilibre de l’écosystème. En effet les variations de sa concentration influencent la biodiversité et la composition des communautés biologiques. Il est concentré dans les algues et de nombreux organismes : fruits de mer, poissons, crustacés…, sources d’iode pour les humains (production d’hormones thyroïdiennes). Plus largement, c’est un composant des aérosols marins qui impactent les propriétés optiques de l’atmosphère et le climat.
1.1. Aspects chimique de l’iode
L’iode I (angl : iodine), un élément rare, appartient au groupe des halogènes comme le fluor, le chlore, le brome… Il partage des caractéristiques similaires avec une électronégativité forte, certes la plus faible des halogènes mais suffisante pour faire de lui un agent oxydant. On ne trouve pas cet oligoélément à l’état d’atome I mais sous plusieurs états d’oxydation, de –1 à +7, ce qui explique la grande diversité des formes iodées existantes. Ce changement d’état lié à une oxydation ou une réduction, dépend de nombreux paramètres physico-chimiques (pH, température, électronégativité, composition, taux de carbone, profondeur, production primaire saisonnière du phytoplancton et selon l’action des organismes vivants). Cette faculté à muter rend d’autant plus difficile la compréhension des processu.
1.1.1. Formes inorganiques de l’iode en milieu marin
Formes inorganiques de l’iode selon l’état d’oxydation
- iodure I– (angl : iodide) état d’oxydation (état d’oxydation -1) : les ions iodure sont la forme prédominante d’iode à la surface des océans tropicaux, d’autant plus en présence de phytoplancton (diatomées).
Le ratio iodure/iodate est fortement influencé, mais localement, par l’advection des courants issus des couches profondes. L’iode est également libéré dans l’eau de mer par des processus géologiques tels que l’érosion des roches et les éruptions volcaniques. Les ions iodure sont assimilés par les organismes marins, tels que les algues et les poissons, et sont également impliqués dans diverses réactions chimiques dans l’eau de mer. - iodate IO3– (angl : iodate) état d’oxydation (état +5) : les ions iodate sont une autre forme stable d’iode au sein des océans. Ils résultent de l’oxydation des ions iodure par des processus microbiens et abiotiques (non biologiques). Les ions iodate peuvent être utilisés par certains micro-organismes marins, notamment les bactéries, comme source d’énergie.
Les eaux des pofondeurs fortement chargées en iodates dans un rapport iodate/iodure supérieur à 10 peuvent remonter des eaux profondes et bousculer les ratios mesurés localement dans des nappes en surface.
Dans une moindre mesure on trouve :
- diiode I2(angl : diiodine), cette forme moléculaire diatomique (état 0), aussi évoquée par abus de langage sous le nom d’iode (iodine), est peu soluble dans l’eau, bien moins que ses sels (iodures, iodates), et surtout très instable, donc peu présente. Elle s’oxyde facilement comme on le verra.
- acide hypoiodeux HIO : peu présent, dans certaines conditions de pH.
Les deux formes stables iodure et iodate représentent l’essentiel de l’iode inorganique total de l’eau de mer. Le diagramme de Pourbaix (figure 1) montre les différents états de l’iode inorganique en solution à 25°C selon le pH et le potentiel redox. Dans la couche superficielle de l’eau de mer (rond vert) l’iodure serait majoritaire. La réalité est un peu différente.

Répartition iodure/iodate dans les eaux coralliennes

La concentration d’iode total est à peu près constante dans les océans, variant peu selon la profondeur. La part d’iodure étant compensée par des iodates et une part d’iode organique. Mais l’iode est il plus présent sous forme d’iodure ou d’iodate ? La réponse n’est pas binaire et impose un certain discernement. En effet le ratio I–/IO3– est très disparate de 30 % à 65 %, les mesures étant souvent rendues difficiles du fait de facteurs géologiques, biologiques et temporels.
Quelles que soient les conditions, la teneur en iodure diminue depuis la surface avec la profondeur où l’iodate a le monopole. Le taux d’iodure mesuré 10 µg/l en surface peut devenir indétectable au-delà de 500 m, l’iode total restant quasi constant (figure 2).
Qu’en est il dans les eaux superficielles ? La question est importante puisque la surface océanique est le grand fournisseur en iodure vers l’atmosphère et, de plus, il s’agit du lieu ou vivent nos coraux zooxanthellés. Là encore les situations sont diverses, largement influencées par l’advection des courants issus des profondeurs venant se mélanger aux eaux superficielles. Shizuo TSUNOGAI dans son rapport Iodine in the Surface Water of the Oceans apporte quelques réponses. Globalement les eaux de surface recèlent 10 fois plus d’iodates que d’iodures. Cependant l’écart diminue à l’approche des latitudes tropicales par exemple 10 µg/l dans le Pacifique nord et près de 30 µg/l dans le Pacifique subtropical où les températures supérieures à 20 °C favorisent notablement l’activité biologique et les condition d’oxydation, le ratio s’approchant de 50 %.
Sur les récifs coralliens l’oxydation en iodure s’effectuant dans les couches très superficielles et tardivement au plus proche du plancton et des rayons solaires, les conditions sont réunies pour que les deux formes iodure et iodates se trouvent dans une proportion similaire.
Réactions impliquant l’iode inorganique en milieu marin
L’oxydoréduction (redox)
C’est une réaction chimique où une substance perd des électrons (chargés négativement) : l’oxydation, tandis qu’une autre en gagne : la réduction. Les transferts d’électrons, impliquent des changements d’état d’oxydation, c’est le cas de l’iode.
Dismutation
Ce type de réaction chimique peut se produire avec des réactions redox. Une substance, à la fois oxydante et réductrice, réagit pour donner deux produits, dont l’un est réduit et l’autre, oxydé. C’est le cas de l’acide hipoïodeux qui peut produire diiode et iodates.
Du fait de ses charges ioniques, en milieu marin l’iode peut subir plusieurs types de réactions chimiques dites iodométriques (figure 2) :
- Oxydoréduction : les iodates se réduisent en iodure qui peuvent eux-même s’oxyder en diiode I2. Ces réactions ont lieu sous l’influence de microorganismes, de la lumière, de l’oxygène, de l’ozone et d’autres facteurs environnementaux.
- Dismutation : un processus complexe par lequel, par exemple, l’acide hypoiodique HIO se transforme en acide iodique 3HIO3 et iode moléculaire I2. L’acide iodique 3HIO3 pouvant ensuite se dissocier pour former l’ion iodate IO3–. On peut observer également une dismutation de l’iodure en diiode I2 et iodate IO3–. Ces réactions se produisent naturellement dans l’environnement, par exemple avec le rayonnement solaire, notamment les rayons ultraviolets (UV), qui induit des réactions photochimiques, selon la concentration d’iode et d’autres facteurs.
1.1.2. Formes organiques de l’iode en milieu marin
Les molécules organiques (contenant du carbone C et de l’iode I) sont issues des organismes marins, en particulier le phytoplancton qui produit le monoiodométhane CH3I, le diiodométhane CH2I2 produit par des réactions biogéochimiques, le triiodométhane CHI3 et d’autres composés organiques plus complexes. L’iode organique est peu présent dans la colonne d’eau mais mesuré à fortes concentration à l’approche des estuaires.
1.2. Aspects biochimiques de l’iode
Bien que sa concentration soit faible en eau de mer il se trouve dans les tissus de nombreux organismes. De l’ordre de 0,08 µg/g dans les plantes séchées, 0,05 µg/g chez les poissons et 0,3 µg/g chez des invertébrés.
1.2.1. Consommation de l’iode par les organismes marins
- Nutriments pour les organismes marins : L’iode est un nutriment essentiel pour de nombreux organismes, en particulier les algues et le phytoplancton qui l’incorporent dans leurs tissus pour divers processus métaboliques, y compris la synthèse d’hormones.
- Bactéries : Elles sont en mesure de réduire les iodates en iodures (réduction microbienne) selon l’environnement et l’espèce.
Dans les eaux de surface la réduction d’iodates en iodure est fortement correllée avec la réduction de nitrates en nitrites dans le processus de dénitrification opéré par les mêmes bactéries.
Dans les eaux profondes aux conditions anoxiques, dans les sédiments, il s’agit plutôt de bactéries réductrices de fer et/ou de sulfate. L’activité bactérienne peut réduire les iodures en diiode et vice versa. - Phytoplancton : comme les algues, il concentre l’iode à un taux supérieur à celui de l’eau de mer. Des études ont mesuré des iodures et iodates de manière très variable selon l’espèce. Les diatomées, l’accumulent sous les deux formes bien que l’iodure soit généralement la forme privilégiée dans le phytoplancton. La réduction par le phytoplancton de l’iodate en iodure dans l’eau s’avère mineure et sans incidence pour l’environnement.
- Végétaux : les algues supérieures, synthétisent l’iode à des concentrations supérieures au taux de l’eau de mer, et ce de manière très importante par les algues brunes telles que certains laminaires qui le concentrent à un taux jusqu’à 100000 fois supérieur.
Les algues assimilent essentiellement des iodures après oxydation en diiode I2 par une enzyme soluble, l’iodure-peroxydase, présente à leur surface. L’iode moléculaire I2 est ensuite hydrolysé en acide hypoiodeux HOI qui peut alors diffuser à travers les parois des cellules. L’iode ainsi réduit serait finalement séquestré essentiellement sous forme inorganique iodure. Par réaction à des stress ou par simple diffusion, les algues génèrent des efflux vers l’eau de mer sous forme d’iodures, d’iodates et de diiode associés à d’autres composés volatiles. Les végétaux en mesure de réduire les iodates en iodures, contribuenr à augmenter le taux d’iodures à la surface des océans. - Invertébrés : selon leurs modes de nutrition ils peuvent absorber des iodures dissous, la forme la plus biodisponible, des iodates, ou des formes organiques via leur régime alimentaire. La préférence dépend de plusieurs facteurs, notamment les conditions environnementales, les espèces d’invertébrés et leurs besoins physiologiques spécifiques. Pour autant, les effets exacts ou l’utilité de l’iode pour ces organismes ne sont pas clairement compris et font toujours l’objet d’études.
Les invertébrés filtreurs : les bivalves (moules, huitres, bénitiers…), les gastéropodes, les éponges, les tuniciers assimilent, mais aussi accumulent l’iode par absorption d’iodure et surtout par la capture des particules phytoplanctoniques. Les consommateurs d’huitres et de violets méditerranéens aux saveurs particulièrement iodées pourront confirmer.
Les autres invertébrés : assimilent l’iode via leur alimentation. Les crustacés (crevettes, crabes…) de même que les échinodermes (étoiles de mer, oursins, concombres de mer), les vers marins… consomment des algues et d’autres organismes riches en iode, déposés sur les substrats. - Poissons :. Ils peuvent assimiler l’iode directement par osmose à travers leurs membranes branchiales, mais de manière limitée. Leur principale source est l’alimentation à base d’autres organismes marins : algues, crustacés et d’autres invertébrés ayant accumulé de l’iode à partir de l’eau de mer ou de leur nourritures. Ils assimilent esentiellment des iodures, les iodates étant réduits en iodure lors de la digestion.
- Bactéries : Elles sont en mesure de réduire les iodates en iodures (réduction microbienne) selon l’environnement et l’espèce.
- Hormones thyroïdiennes : L’iode est un composant crucial des hormones thyroïdiennes, telles que la thyroxine (T4) et la triiodothyronine (T3), dont le rôle est essentiel dans l’oxydation cellulaire, la formation des cellules sanguines, la circulation, la reproduction et d’autres métabolisme des poissons et d’autres espèces marines.
- Réponse immunitaire : L’iode joue également un rôle dans la réponse immunitaire des organismes marins. Il peut être impliqué dans la protection contre les agents pathogènes et les stress environnementaux.
1.2.3. L’iode et les coraux
L’iode est un oligo-élément essentiel pour le corail. Son rôle dans les récifs coralliens s’avère complexe avec encore de nombreuses inconnues. Les coraux assimilent assimilent des composés iodés inorganiques (iodures et iodates) et organiques, de même que leurs zooxanthelles symbiotiques. Il suffit de sortir un corail de l’eau pour en inhaler immédiatement la présence. Ils absorbent des composés dissous au travers de leur tissus et capturent des proies inertes ou vivantes, chargées d’iode organique issu des bactéries, phytoplancton, zooplancton, neige marine, particules…. Leurs processus d’assimilation ne sont pas à ce jour bien expliqués.
On mesure dans les squelettes coralliens un certain pourcentage d’iodate assimilé durant la calcification, les ions iodate se substituant aux carbonates, là encore, sans que l’on sache exactement pourquoi. Pour l’anecdote, la forme iodate étant liée au taux d’oxydation du milieu, on étudie aujourd’hui le ratio calcium/iode des squelettes de coraux profonds comme traceurs, pour évaluer, par extrapolation, les conditions de production primaire (phytoplancton) et d’oxydoréduction durant l’évolution des océans.
L’iode améliore la réponse immunitaire. C’est un aspect particulièrement important pour les coraux SPS aux tissus fins, sensibles aux radiations lumineuses. Il assure une certaine protection contre le blanchissement.
A contrario, un niveau élevé associé à des conditions particulières d’oxydation peut le rendre toxique pour les zooxanthelles, contribuant au blanchissement du corail.
Finalement, bien qu’on en sache peu sur l’intérêt de l’iode en tant que nutriment, sa présence dans l’environnement corallien peut avoir des implications pour la santé des coraux et la symbiose avec leurs zooxanthelles.
1.4. Le cycle de l’iode
L’océan et les sédiments marins constituent le réservoir principal d’iode, essentiellement sous forme iodate et iodure. Contrairement au cycle de l’azote que nous connaissons tous, le cycle biogéochimique de l’iode repose sur d’importants échanges entre les compartiments océanique et atmosphérique. On peut le résumer ainsi :
- Libération dans l’atmosphère : L’iode est libéré dans l’environnement par des processus géologiques tels que l’érosion des roches, les éruptions volcaniques, l’activité humaine et les émissions des océans eux-mêmes.
- Transport terrestre : l’iode dissout s’infiltre et diffuse dans les terres, acheminé vers les mers via les cours d’eau.
- Sédimentation : au fil du temps les composés iodés (algues, organismes marins, apports atmosphériques…) s’accumulent dans les sédiments. Ces derniers constituent un important réservoir dynamique d’iode, libérant dans l’eau ou absorbant des ions iodures selon les conditions environnementales (pH, redox).
- Libération depuis les sédiments : L’iode se libère par la décomposition et dissolution de matières organiques iodées, par des réactions chimiques entre les minéraux et composés iodés ainsi que par l’activité biologique de micro-organismes (bactéries spécifiques). Ces formes d’iodes sont consommées par les organismes marins et participent aux réactions d’oxydoréduction iodométriques.
- Réactions chimiques iodométriques : l’iode se transforme à travers différents états d’oxydation en prenant ou donnant des électrons.
- Réduction des ions iodate IO3– en ion iodure I– : elle peut être chimique via des substances organiques dissoutes ou microbienne via certaines bactéries anaérobies qui utilisent l’ion iodate comme accepteur d’électrons.
- Oxydation de l’ion iodure I– en ion iodate : la réaction liée à l’oxygène dissous est possible, mais lente sur plusieurs mois ou années et peu significative. Il semble bien que cette oxydation est réalisée beaucoup plus efficacement et rapidement par les bactéries nitrifiantes (Nitrosomonas sp. et Nitrosococcus oceani oxydant NH4 en NO2–) et ce, non seulement dans le zone aphotique exempte de lumière, mais dans toute la colonne d’eau.
- Oxydation de l’ion iodure I– en diiode moléculaire I2: l’ion iodure s’oxyde en diiode pour former l’ion triiodure I3–, lui-même transfoormé ultérieurement.
- Dismutation spontanée : il s’agit de réactions chimiques simultanées d’auto-oxydation et de réduction impliquant le diiode I2, l’ion hypoiodite HIO, et l’ion iodate IO3–.
- Assimilation par les organismes marins : Les ions iodure I- et iodate IO3- présents dans l’eau de mer sont absorbés par les organismes marins (bactéries, phytoplancton, algues, éponges…) entrant dans la chaîne alimentaire des autres formes de vie marine (poissons, crustacés, invertébrés…). Les organismes marins jouent un rôle clé dans le cycle de l’iode en assimilant et en libérant l’iode au cours de leurs existence. Les processus métaboliques et de reproduction des organismes marins contribuent au transfert de l’iode à travers la chaîne alimentaire marine.
- Aérosolisation de l’iode océanique : Les algues et le phytoplancton des zones côtières possèdent le matériel enzymatique nécessaire à la capture des iodures dans l’eau de mer, et également à l’émission de composés volatils iodés (CVI) les iodocarbonyles CH3I, CH2I2… et d’iode moléculaire I2. Dans l’atmosphère les CVI sont oxydés par l’ozone O3 et les UV en aérosols, un pool d’espèces oxydées OIO, I2O4, I2O5… constitué de particules de l’ordre du nanomètre (nucléation).
- Transport atmosphérique : les particules légères en suspension dans l’air sont transportées par les vents sur de longues distances, durant quelques jours à plusieurs mois, et se condensent plus tard contribuant à la formation de nuages. Elles précipitent avec les pluies à la surface des continents et des océans, rendus biodisponibles dans l’eau, les sols et la flore. L’iode rejoint ainsi la chaine alimentaire. L’océan, plus précisément ses algues supérieures, sont ainsi le plus grand pourvoyeur d’iode vers l’atmosphère. Les aérosols d’iode influençent la chimie de l’atmosphère et contribuent aux cycles de certains composés. Associé à d’autres halogènes il serait responsable de 40 % de la destruction de l’ozone atmosphérique.

2. L’iode en aquarium marin
La compréhension des processus impliquant l’iode dans les océans devrait permettre de mieux appréhender son comportement en aquarium marin et récifal. Son cycle y est bien évidemment simplifié mais beaucoup plus rapide et critique pour l’équilibre de l’aquarium et ses protégés.
2.1. Le cycle de l’iode en aquarium
L’essentiel de l’iode dissout dans l’eau de l’aquarium marin est inorganique. Le cycle de l’iode dans un aquarium récifal peut se résumer ainsi :
- Importation : l’iode entre dans l’aquarium récifal via le sel synthétique utilisé pour les changements d’eau, les suppléments d’iode, et surtout les aliments.
- Consommation par les organismes : les bactéries, les algues, la microfaune et méiofaune, les invertébrés et coraux, les poissons et d’autres organismes assimilent l’iode principalement sous forme d’ions iodure I– et parfois d’ions iodate IO3– pour leurs métabolismes.
- Réactions d’oxydoréduction, dismutation : Dans l’eau, les ions iodure I– vont essentiellement être oxydés en ions iodate IO3– par l’activité microbienne, l’assimilation des végétaux et selon les paramètres de l’eau (pH, redox, lumière, UV, ozone…).
- Exportation l’iode est extrait via des médias de filtration ou de traitement d’eau comme nous l’aborderons.
2.2. L’alimentation, 1ère source d’iode en aquarium
Les organismes aquatiques contiennent les plus grandes concentrations d’iode, bien plus que les sources terrestres. Ils puisent ces éléments à la fois dans leur nourriture et dans l’eau, puis les concentrent dans différents tissus. Leur chair contient plus de 60 micro-éléments, plus ou moins indispensables, selon les espèces : potassium, phosphore, iode, selénium, fer, zinc…
Les algues et les invertébrés comptent parmi les plus riches (tableau 1). Les poissons peuvent en contenir notablement s’ils sont d’origine sauvage, les spécimens d’élevage dépendant de leur alimentation.
| Algues séchées | Kombu Breton | 450000 |
|---|---|---|
| Agar, dulse, wakamé | 35000 | |
| Nori | 5000 – 9000 | |
| Spiruline | < 200 | |
| Mollusques | Bigorneau | 570 |
| Moules, huitres, bulot | 100 – 130 | |
| Praire, palourde | 80 | |
| St Jacques | 20 | |
| Crustacés | Langoustine | 400 |
| Crevette | 260 | |
| Crabe | 100 | |
| Poissons | Cabillaud | 100 – 300 |
| Lieu, anchois, maquereau | 80 | |
| Saumon, thon | 30 | |
| Surimi | 7 | |
| Céphalopodes | Calamar, seiche, poulpe | 20 – 30 |
| Poissons eau douce | Truite, carpe | 2 – 8 |
| Légumes | Epinard | <20 |
2.3. Dérives d’iode en aquarium récifal : causes, effets
Les effets de l’iode sur les organismes dépendent de son état d’oxydation, sa réactivité, sa concentration et de nombreux paramètres. La chimie de l’iode est complexe et malheureusement pour l’aquariophile, difficilement prévisible. Plus qu’en eau de mer, dans le milieu fermé, confiné et perfusé d’un aquarium, les dérives peuvent être rapides et de nombreuses réactions susceptibles de s’initier, s’enchainer sans alerte, ajoutées à la formation de composés iodés organiques potentiellement toxiques à concentrations élevées. La difficulté de cerner la situation impose de maintenir l’élément iode entre des valeurs admises que l’on évoquera.
2.3.1. Carence en iode : effets, bioindicateurs
Les causes d’une carence, notamment en iodure, peuvent être liées à plusieurs facteurs :
- Absorptions : par un traitement au charbon actif microporeux, ou certaines zéolithes.
- Excès d’algues : en quantité, cultivées en refuge ou réacteur ou non, leur consommation réduit le taux dissous biodisponible.
- Activité bactérienne : elle peut être intense du fait d’apports en carbone, azote et phosphore.
- Réactions chimiques : oxydation de iodures en iodates.
- Supplémentation : si elle est insuffisante, mal évaluée.
- Sels : mal dosés, ils ne permettent pas de compenser les consommations d’iode par les simples changements d’eau.
- Réacteur à hydroxyde de calcium : tout moyen susceptible d’augmenter le pH favorise la dismutation de l’iodure en iodate globalement moins assimilé par les organismes. C’est le cas en sortie d’un RAH à pH 12,5 (figure 1). Cette situation de carence peut ne pas être détectée par certains tests.
Bioindicateurs d’une carence en iode :
- Algues, phytoplancton :
- Croissance réduite des algues, notamment supérieures plus consommatrices.
- De même que les algues calcaires (corallines) dont on ne perçoit plus le liseré extérieur clair, signe de croissance.
- Gros consommateur, la croissance du phytoplancton est inhibée à faible taux d’iodure, son absence sur les vitres est un signe.
- Invertébrés :
- Absence de mues des crevettes, ou incomplète.
- Antennes des crevettes déformées.
- Coraux :
- Croissance ralentie : les métabolismes (croissance, calcification…) liés au facteur limitant iode sont ralentis. Une carence serait plus visible sur les coraux mous octocoralliaires (Xénia, Anthelia, Clavularia, coraux cuirs, gorgones…), peut être en raison d’une biomasse et d’un besoin supérieurs aux SPS et LPS.
- Perte de l’intensité de la couleur : comme pour le brome, une carence en iode réduit la synthèse de pigments notamment protéiques tels que les chromoprotéines : cyanoprotéines (bleu), chloroprotéines (vert), rhodoprotéines (rouge), cléroprotéines (orange), poccilloporines (une GFP Green Fluorescent Protein contribuant aux couleurs rose et bleue des coraux, ainsi que les fluoroprotéines qui activent la fluorescence sous éclairage ultraviolet ou bleu.
- Blanchissement : du fait d’une plus faible densité de zooxanthelles en carence d’iode.
-
Brûlures et nécroses au sommet : très réactif avec l’oxygène, l’iode comme le brome est sous sa forme iodure I– un antioxydant qui permet de lutter contre le stress oxydatif, c’est d’ailleurs un rôle essentiel en aquarium. Il contribuerait ainsi à améliorer la résistance des coraux et corallines aux brûlures ou à la décoloration lorsqu’ils sont exposés à une lumière forte, indépendamment bien entendu d’autres causes potentielles liées à la qualité de l’eau.
2.3.2. Excès en iode : effets, bioindicateurs
Les différentes formes d’iodes sont plus ou moins toxiques. Une hiérarchie placerait le diiode très toxique, mais rapidement dismuté sous une autre forme il n’est pas le plus critique, puis l’iodate toxique à forte dose, enfin l’iodure présente un moindre risque. Le risque le plus important serait d’accumuler des iodates moins consommés et ce jusqu’à un niveau critique.
L’iode agirait pour la protection des coraux contre le blanchissement. A contrario, un niveau élevé associé à des conditions particulières d’oxydation peuvent le rendre toxique, notamment pour les zooxanthelles, contribuant au blanchissement des coraux.
Les causes d’un excès pourraient se justifier de plusieurs manières :
- Oxydation : importante, alors les iodures transformés en iodates s’accumulent parce que moins consommés. Elle peut être le fait d’un éclairage intense, de l’utilisation de traitements stérilisants tels que les UV, l’ozone. De tels systèmes peuvent nécessiter d’amplifier la supplémentation en iode.
- Alimentation : une suralimentation des poissons et invertébrés ou déséquilibrée.
- Chaîne alimentaire : l’insuffisance ou la rupture de la chaîne aimentaire s’oppose à la bonne réalisation du cycle en aquarium. Elle peut être liée à la microfaune (bactéries…), la méiofaune ou des détritivores insuffisants..
- Traitement des dégradation de MO : les matières organiques accumulées, issues des excréments, débris, nourritures, algues du refuge non élaguées, et insuffisamment évacuées, filtrées, écumées… libèrent de l’iode lors de leur dégradation.
- Sels synthétique : sous dosés, les changements d’eau accentuent le déséquilibre en iode.
- Supplémentation : mal calculée, la dérive s’accule jusqu’à l’excès.
Bioindicateurs d’un excès en iode :
- Bactéries : la population et le spectre bactérien insuffisants, et le système se rompt. Ce symptôme est potentiellement masqué par bien d’autres causes. La bonne connaissance de son aquarium contribue au dignostic.
- Végétaux :
- Algues : un excès d’iode accentue leut croissance, les microalgues sur les vitres sont plus visibles. De plus, sous forme organique ou inorganique l’iode contribue à la défense des algues contre les herbivores, elles sont moins élaguées. Il peut être judicieux de suspendre les apports d’iode en cas d’invasion algale, conjointement aux autres moyens de lutte.
- A contrario, la croissance du phytoplancton n’est pas empêchée à des doses importantes d’iodate et d’iodure. Elle n’est pas significative.
- Invertébrés : on a pu mesurer des problèmes de reproduction chez les invertébrés. il n’y a cependant pas de donnée concernant le niveau de toxicité sur les organismes marins et le récifaliste ne sait rien des taux de iodate et iodure susceptibles d’occasionner des problèmes.
- Coraux : selon les aquariophiles, des taux très importants au-delà de 150 µg/l affectent les coraux de manière très inégale avec des symptômes variés au sein d’une même famille, sans possibilité d’établir une hiérarchie entre coraux mous, LPS et SPS. Le constat peut s’échelonner depuis une absence de symptôme jusqu’à la mort de colonies. Indépendamment des mesures, l’œil critique de l’aquariophile tentera de détecter des évolutions ciblées, parfois lentes. Elles peuvent se traduire de plusieurs manières :
- Rétraction des polypes : premier signe de stress oxydatif chez certains spécimens.
- Couleurs pâlissent : l’ensemble de la colonie devient terne.
- Nécroses locales de tissus : due à un stress oxydatif lequel, comme après tout stress, peut ne plus répondre à l’invasion de bactéries pathogènes et parasites opportunistes.
- Mort des coraux : c’est le scénario classique d’une faiblesse extrême, les tissus réduits au minimum se desquament en totalité.
- Poissons : adultes ils supportent des taux relativement élevés, plus que ce qui est admissible en aquarium récifal. A l’extrême ils occasionnent des problèmes de santé, des troubles thyroïdiens ou respiratoires. Un excès perturbe le développement des larves aux premier stades de leur développement.
2.3.3. L’iode impacte-t-il l’équilibre redox de l’aquarium ?
On évoque beaucoup les réactions d’oxydation et de réduction dans lesquelles l’iode est impliqué. Il est donc légitime de se poser la question s’il est en mesure d’influer sur le redox de l’aquarium, et avec quelle importance. Ceci, d’autant plus dans un espace en circuit clos où les réactions chimiques, même locales, ont toujours la probabilité d’impacter rapidement le milieu, plus qu’elles ne le feraient face à l’immensité de l’océan.
En aquarium l’iode peut agir comme oxydant et réducteur selon les conditions spécifiques. L’iodure peut être oxydé en formes d’iode plus réactives et toxiques : l’ion iodate IO3–, mais surtout l’iode moléculaire I2 et l’ion hypoiodite IO–, et participer à des réactions d’oxydoréduction avec de nombreux composants de l’eau : oxygène dissous, nitrates, métaux Cu, Mn, Zn…, composés organiques… Mais est-ce suffisant pour impacter notablement le redox de l’aquarium.
Toute réaction d’oxydoréduction se poursuit jusqu’à un nouvel équilibre. Dans une eau de composition équilibrée et stable, tous autres paramètres gérés, en présence d’un flux d’apport et de consommation d’iode régulier, il est peu probable qu’il y ait matière à le déséquilibrer. D’un autre côté le faible taux de cet oligoélément ne constitue pas une offre importante d’ions à mobiliser face à des composés beaucoup plus concentrés. Il est donc peu probable qu’en restant dans la marge admise, les apports réguliers d’iode génèrent un déséquilibre redox de l’aquarium. L’expérience montre que le redox d’un aquarium n’a pas fondamentalement évolué à des taux de 150 µg/l.
Il en serait autrement si cet apport d’iode devenait excessif au point de d’enclencher une oxydoréduction anormale. Tout est question de concentration et de paramètres physicochimiques environnants. Au delà de perturber l’équilibre redox, des réactions indésirables peuvent se déclencher dont les effets sur les organismes marins (stress, dysfonctionnements biologiques…) dépasseraient la relative problématique d’une dérive de quelques millivolts.
2.4. L’iode en traitement antiseptique des coraux et poissons
Les formes inorganiques iodure I– et iodate IO3– ont une action antimicrobienne très faible mais la forme diiode I2 est un agent antibactérien efficace. Le diiode I2, instable en eau de mer est vite dismuté sous une autre forme inorganique, il n’a donc aucun effet antiseptique dans l’aquarium. Son usage est réservé aux traitements prophylactiques. On l’utilise en bains, dissous dans l’eau douce ou l’alcool, comme antiseptique pour désinfecter un corail, le déparasiter, prévenir ou guérir une infection bactérienne.

Les différentes formes :
- Lugol : Le diiode I2 est très peu soluble dans l’eau, on améliore sa solubilité par association : 1 % de diiode I2 et 2 % d’iodure de potassium KI en excès. La complexation des deux ions forme des ions triiodure I3– dans une solution de couleur brune.La masse de l’élément iode I actif dans le lugol représente 86,65 % du composé (I2 + 2KI).
Pour mémoire, dans l’eau marine, selon le contexte, le triodure se décompose en iodure assimilable, et le diiode. Ce dernier beaucoup plus toxique ne justifie pas l’utilisation de lugol pour supplémenter la consommation dans l’eau d’un aquarium. On lui préfère l’iodure, sous forme KI, moins risqué et plus stable.
Préparation du lugol : Il existe des solutions commerciales prêtes à l’emploi. Si besoin, une préparation à 0,5 % contient 1 litre d’eau osmosée, 10 grammes d’iodure de potassium KI et 5 grammes de diiode I2 en cristaux.
Traitement avec le lugol des coraux ou lésion des poissons : 15mn dans un bain dosé à 5 gouttes de lugol par litre d’eau de mer. Ce rapport mentionne un traitement de 3 bains les jours 1, 3 et 6 dans une solution à 1 mL de lugol pour 3 litres d’eau salée. - Povidone iodée (Bétadine flacon jaune) : un antiseptique, complexe organique à 10 % d’iode actif, à large spectre, bactéricide, fongicide, virucide et par expérience antihelminthique contre les planaires. ,.
Traitement des coraux : 15 mn en bain à 2 ml par litre d’eau de mer, puis rincer à l’eau de mer.
Traitement d’une blessure de poisson : tamponner la lésion avec une solution à 5 ml par litre d’eau de mer. - Teinture d’iode : une solution de diiode dissous dans l’éthanol.
3. Mesurer le taux d’iode dissous
3.1. Taux recommandé
Compte tenu des risques inhérents à un excès d’iode, et de la difficulté à déterminer l’équilibre entre les différentes formes d’iode il est essentiel de prévenir la dérive excessive de l’une ou l’autre forme en maintenant la concentration de l’élément I dans une marge admise entre 40 et 90 µg/l (valeurs expérimentales) et viser la concentration moyenne de l’eau de mer 60 µg/l (0.06 mg/l).
Tout ajout dans l’aquarium devrait être réalisé en connaissance de la situation. Pour une bonne compréhension, ces mesures devraient distinguer les différentes formes d’iode : diiode, iodures et iodates. Les actions à mener devraient s’adapter aux concentrations des diverses formes.
- Un taux de iodates correct sans iodure signifie que le cycle biologique n’est pas satisfaisant.
- Un taux d’iodure insuffisant pourrait, sans connaitre le taux de iodates, conduire à en rajouter et atteindre un taux de iodates critique.
- La présence d’iodures en l’absence d’ajout révèle une production probablement par les algues.
3.2. Tests colorimétriques
Il existe peu de tests dédiés à l’aquariophilie récifale. Ils ne détectent qu’une ou deux formes d’iode, parfois les iodures I– et rarement les iodates IO3–, ce qui rend impossible la comparaison avec le taux d’iode I de l’eau de merl. Par conséquent les valeurs obtenues sont souvent plus faibles que le total d’iode contenu dans l’aquarium. Elles peuvent masquer un taux excessif de iodates plus toxiques.
Le diiode étant instable, en cas d’utilisation de lugol les mesures ne doivent pas se réaliser après introduction du produit mais plutôt entre deux apports.
Nota : Les notices commerciales annoncent mesurer l’iode iodine (I) dont on sait que cette forme n’existe pas dans l’eau de mer, ou de manière très transitoire, non significative. Plus précisémment, les anglophones évoquent iodine pour parler de l’iode de manière générale. Un test colorimétrique aquariophile qui prétend mesurer l’iode iodine sans autre précision est tout bonnement inutile puisque l’on ne sait pas ce qu’il mesure réellement.
- Salifert I2 PROFITEST Iodite Iodate Iodine : Ce test mesure les iodures d’une part et d’autre part la somme des autres formes d’iodes lesquelles se constituent majoritairement de iodate. Il est donc pertinent pour nos aquariums, sous réserve de la fiabilité des résultats.
- Seachem MultiTest Iodine/Iodide : mesure iodine (voir le commentaire ci-dessus) et les iodures I– dans une gamme 0,005 à 0,10 mg/l.
- Red Sea IODINE PRO TEST KIT : Mesure(rait) le taux d’iode total. Aucun test colorimétrique aquariophile ne sait actuellement mesurer l’iode total, c’est à dire sous toutes ses formes. En l’absence de précision on ne sait pas ce que mesure réellement ce test. Il ne doit surtout pas laisser croire que son résultat est comparable à celui d’une analyse ICP.
- Colombo Iodine test : mesure iodine, donc globalement de l’iode, mais plus précisémment que mesure-t-il ?




3.3. Tests ICP

Il existe des méthodes beaucoup plus précises comme l’analyse ICP-OES (Inductively coupled plasma – optical emission spectrometry). La solution est ionisée dans un plasma d’argon. Un spectromètre d’émission optique analyse ensuite les ions séparément, jusqu’aux éléments traces. Des laboratoires professionnels (TritonLab, ATI, MarineLab, Fauna marin, Aquaforest…) proposent maintenant une offre adaptée aux aquariophiles marins. L’analyse ICP mesure la somme de tous les éléments iode I, quelles que soient leurs formes d’origine (diiode, iodures et iodates).
La valeur ICP est directement exploitable par rapport au taux de l’eau de mer 60 µg/l. Cependant, elle ne détermine pas le ratio entre les différentes formes d’iode. Un résultat ICP correct pourrait masquer une carence en iodure biodisponible.
3.4. Observation visuelle
L’observation régulière de l’aquarium, notamment des bioindicateurs listés auparavant, est un excellent moyen de déceler l’amorce de dérives à confirmer ou infirmer par un test ICP.
4. Prévenir, maîtriser les dérives de concentration en iode
4.1. Augmenter le taux d’iode
Plusieurs voies s’offrent à l’aquariophile :
- Compléments, suppléments : la forme iodure étant la plus assimilée par les organismes, et stable, c’est celle que l’on privilégie pour augmenter la concentration. Pour cela on utilise en général de l’iodure de potassium KI et, si la concentration de potassium dans l’eau est déjà haute, de l’iodure de sodium NaI. Dans tous les cas il faut tenir compte de la concentration réelle de l’élément iode I, liée aux masses moléculaires des éléments.
Dans l’eau de mer, en présence de sels, l’iodure de potassium se dissocie en ions iodure I⁻ et potassium (ou Na⁺ dans le cas de NaI). Ces ions, stables, sont ensuite biodisponibles pour les organismes de l’aquarium. L’iodure peut partiellement se transformer en d’autres formes d’iode, notamment en iodate (IO₃⁻), par des processus biologiques ou chimiques et, de manière très négligeable, en diiode I2 sous l’action de l’oxygène dissout et de la photooxydation. Cette oxydation en diiode toxique est transitoire puisqu’il peut rapidement dismuter en iodate et également iodure.
L’augmentation hebdomadaire maximum de l’élément iode doit être limitée à 10 µg/l.
Le marché propose des solutions prêtes à l’emploi évoquées plus loin. Il est également possible de préparer sa propre solution comme on le verra. - Aliments : les aliments pour poissons et coraux (phyto et zooplanctons, nourritures pour poissons et invertébrés) contiennent de l’iodure, de l’iodate et d’autres formes d’iode organique tels que des acides aminés iodés. Les aliments comme le krill, les macroalgues, les bivalves, le poisson… sont plus riches et devraient constituer une part de la ration quotidienne.
- Sel synthétique riche en iode, utilisé pour les changements d’eau.
4.2. Diminuer le taux d’iode
- Charbon actif : Le charbon actif est l’absorbant couramment utilisé en aquariophilie pour extraire l’iode présent dans l’eau par physisorption soit par chimisorption. Bien que son affinité soit meilleure avec le diiode, l’expérience montre que sont efficaité est bonne sur les autres formes d’iode inorganique iodure et iodates.
- Zéolites : on exploite ici la propriété d’absorption des zéolites, des minéraux poreux qui, comme d’autres types de médias : alumine, magnésie, gel de silice, peuvent retenir des composés chimiques de petite taille. La plus efficace en présence d’iode est la zéolithe de type A de structure spécifique, utilisée dans des applications industrielles de purification de l’eau, elle ne semble pas proposée aux aquariophiles.
On évoque souvent sa remarquable facilité d’adsorption par fixation des ions, laquelle dépend de la composition du minerai. Cependant, en aquariophilie marine la concentration en ions Na+, K+, Mg2+ et Ca2+ de l’eau de mer est telle que les ions minoritaires ont peu de chance de se fixer. Les anions tels que nitrites NO2–, nitrates NO3–, phosphates PO43-, iodure I–, iodates IO3–… n’ont pas d’affinité avec les aluminosilicates. L’adsorption n’est donc pas le mode d’action attendu en aquariophilie. - Résines échangeuses d’ions : Des résines échangeuses d’ions sont spécialement formulées avec des polymères spécifiques pour cibler l’iode dans l’eau. Cependant, elles ne semblent pas à ce jour destinée au marché aquariophile.
- Développer les algues et phytoplancton : ce sont de gros consommateurs d’iode. Encore faut-il les élaguer avant dégradation.
- Développer la faune bactérienne : consommatrice d’iode.
- Ecumage : afin d’empêcher les matières organiques (particules, décompositions, bactéries…) et les organismes morts de libérer l’iode assimilé.
- Evacuer les déchets : adapter le brassage, l’évacuation des sédiments et déchets, le turn-over… avant traitements.
- Changements d’eau : à condition que le sel utilisé soit aprauvri.
- Elagage des algues : extraire les algues du bac et des refuges/réacteurs algaux avant qu’elles ne relarguent l’iode assimilé sous une autre forme ou lors de leur dégradation.
- Evaporation : l’oxydation sous éclairage puissant génère des particules légères diffusées dans l’air. Un moyen qui a ses limites pratiques en aquariophilie marine (éclairage adapté en priorité aux animaux, niveaux d’eau, dêpots de sel, oxydations des matériaux)
4.3. Supplémenter en iode
A la fréquente question "faut-il ajouter de l’iode ?", compte tenu de tout ce qui a été évoqué, la réponse est bien évidemment oui, et quotidiennement, ne serait-ce que par la nourriture, et c’est probablement la voie à privilégier. Cet apport est cependant difficile à évaluer puisqu’il dépend de nombreux facteurs (échanges internes, nature des organismes, biomasse du bac, algues…). Des coraux mous ont des besoins en iodures beaucoup plus importants que des SPS dont les tissus vivants ne représentent qu’une infime partie de l’animal. Bref, chaque bac connait un niveau de consommation qui lui est propre. Ainsi, on a pu mesurer des taux importants dans des bacs non supplémentés en iode, et inversement. Rajouter de l’iode, même à petites doses régulières, sans considération des risques serait la pire attitude, susceptible de vouer le bac à sa perte. Chaque aquariophile doit en avoir conscience avant tout ajout.
Des mesures en aquarium ont montré que le taux pouvait chuter en quelques jours d’un taux normal à zéro. La consommation s’avère parfois très rapide. Puisque les tests colorimétriques ne donnent qu’une vision imparfaite et tronquée de la situation. Les récifalistes ont beaucoup évolué vers une démarche pragmatique incitée par le prix important des souches actuelles. Ils réalisent des tests ICP selon une fréquence adaptée à leurs constats.
4.4. Compositions d’iode : produits, dosage, utilisation
4.4.1. Produits commerciaux
Parmi les produits du commerce peu annoncent leur nature et concentration (Tridacna anonce : Solution d’iode 5% – iodure de Potassium). Certains précisent la forme d’iode introduite, mais sans la concentration (Elos Extra iodide, Two Little Fishes Iodine Concentrate… ) d’autres les concentrations sans les formes d’iode (Seachem Reef Iodide…), d’autres enfin ni les formes d’iode, ni les concentration (Prodibio Iodi+, Mariscience, Tropic Marin Procoral Jode, ATI I…). Difficile avec ces derniers, d’adopter une méthode de supplémentation, d’autant plus que les produits peuvent contenir des adjuvants, acides organiques, chélatants et stabilisants, tels que l’EDTA.
Quand il s’agit d’iodure de potassium, les solutions sont vendues à des concentrations très variables de 0,5 % à 5% ( 50 mg KI / litre). Les plus concentrées nécessitent une injection à la goutte près. Il est préférable d’utiliser des dilutions de l’ordre de 0,5 à 1 % lesquelles présentent moins de risques en cas de surdosage malencontreux et sont plus adapatées au petit débit d’une pompe doseuse.
Les recommandations préconisent parfois des dosages. Elles sont toutefois très disparates, dans un rapport 1 à 10, soit un équivalent de 7 à 70 µg/l d’iode injecté quotidiennement. Ces dernières sont forcément dangereuses. Bref aucune recommandation n’est bonne, chaque protocole doit résulter de mesures préalables factuelles.





4.4.2. Préparations personnelles
Produits utilisés
Dans la pratique on utilise deux produits :
- Iodure de potassium KI : c’est le composé le plus utilisé. Il se présente sous la forme d’un solide cristallisé blanc Très soluble dans l’eau, les ions potassium K+ et iodure I– se dissocient dans l’eau. L’iodure en solution est ainsi directement biodisponible. La masse de l’élément iode I actif qui nous intéresse représente 76,45 % de la molécule KI.
- Iodure de sodium : il est utilisé en remplacement de KI lorsque la concentration en potassium dans l’eau est à son maximum. Il se présente sous forme de cristaux translucides ou blancs. Plus hygroscopique, il est moins facile à manipuler et conserver. Également très soluble dans l’eau, les ions sodium Na+ et iodure I– se dissocient dans l’eau, l’iodure est ainsi facilement assimilable. La masse de l’élément iode I actif représente 84,66 % de la molécule NaI.
Préparation, dosages
Les produits se trouvent couramment en pharmacie, dans le commerce aquariophile (qualité labo analyse) ou en droguerie où il conviendra d’en vérifier la pureté.
La préparation à réaliser dépend du pourcentage de l’élément actif dans la molécule ou le composé (iode I), du volume du contenant, celui du bac, du taux de dilution… Les risques d’erreur sont lourds de conséquence, il est préférable d’utiliser une préparation diluée : plutôt 0,5 % que 5 %. Cette dernière étant réservée à une incorporation ponctuelle au compte-goutte.
Connaissant le taux d’iode actuel, et selon son évolution entre deux tests compte tenu des apports et des changements d’eau intermédiaires on se fixe une règle d’apport. Il est préférable de réaliser des ajouts quotidiens plutôt qu’hebdomadaires. Le micro dosage s’avère ici une méthode tout à fait adaptée.
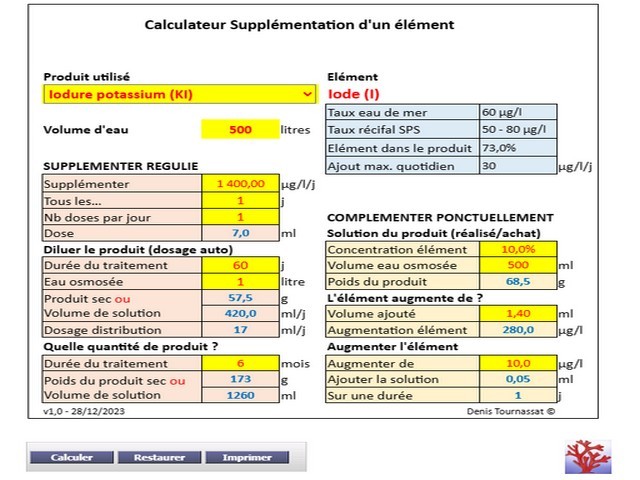
La préparation de la solution peut nécessiter une dilution plus importante en cas de supplémentation quotidienne par pompe doseuse, en une, deux ou plusieurs distributions. Les risques d’erreurs de calcul sont nombreux. je vous propose de vérifier les vôtres avec ce Calculateur de supplémentation mono-élément.
Manipulations, conservation
L’iode sous forme de cristaux est dangereux, nocif par inhalation ou contact avec la peau et attaque certains plastiques. Ne pas inhaler, ni toucher directement. Les produits doivent être manipulés avec les précautions d’usage.
L’iodure s’oxyde en présence d’air et surtout de lumière, chaleur et acides. La composition du contenant n’est alors plus celle prévue. Préparer la quantité pour une durée limitée de l’ordre de 3 mois. Conserver les solutions dans un récipient opaque en verre, polypropylène (PP) ou polyéthylène haute densité (PEHD), étanche, à l’abri de l’air, de la lumière et au frais.
4.4.3. Introduction de l’iode dans l’aquarium
Pour éviter des réactions d’oxydation de l’iodure, il est recommandé d’injecter l’iodure de potassium ou de sodium :
- Régulièrement, plutôt chaque jour que chaque semaine ou mois.
- Dans un lieu brassé pour dissolution immédiate, juste en amont ou en aval de la pompe de remontée.
- La nuit, éclairage éteint pour éviter la photooxydation.
- Matériel source d’oxydation tels que UV, ozone, éteints une trentaine de minutes.
- Loin du RAH et décaler les injections d’iode de celles d’hydroxyde de calcium.
5. Synthèse de la maintenance de l’iode
Pour clore cette publication, ce tableau résumé.
| Taux | Normal : 60 µg/l | |
|---|---|---|
| Carence | Excès | |
| <20 µg/l | > 90 mg/l | |
| Bio indicateurs |
|
|
| Causes |
|
|
| Actions | Remonter le taux
|
Réduire le taux
|
5. En savoir plus
- Evolution des mécanismes d’accumulation et de transport de l’iode dans les organismes marins : étude de la structure/fonction des protéines du métabolisme iodé chez la bactérie zobellia galactanivorans, J-B Fournier – janvier 2014
- L’iode : 210 ans de recherche au service de la société, Antoine Brunel, Côme Cattin, Camille Chartier – Journal de physique et de chimie des étudiants, 01/2022
- Iodine in the Surface Water of the Ocean, Shizuo TSUNOGAI – Journal of the Oceanographical Society of Japan 04/1971
- Oxidation of iodide to iodate by cultures of marine ammonia-oxidising bacteria, Claire Hughes – Science Direct, Marine Chemistry
08/2021 - Etude des mécanismes d’accumulation de l’iode chez l’algue brune Laminaria digitata et chez les mammifères, Elodie Verhaeghe – Thèse HAL open science, 01/2009
- Iodine and fluorine concentrations in seaweeds of the Arabian Gulf identified by morphology and DNA barcodes, Hanan Al-Adilah , – Botanic marina, 2020
- Common aquarium antiseptics do not cause long-term shifts in coral microbiota but may impact coral growth rates, J. Grace Klinges – Frontiers in Marine Science – 11/2023
- Nutrition and Metabolism of Minerals in Fish, Santosh P. Lall – Animals, 2021
- Nucléation et formation de nouvelles particules à haute altitude, Clémence Rose – Université Blaise Pascal,Thèse HAL open science, 11/2014
- L’iode : 210 ans de recherche au service de la société, Antoine Brunel, Côme Cattin, Camille Chartier – JPCE, 01/2022
- Iodine in Marine Aquaria: Part I – Randy Holmes-Farley – Reef.com – (march 2003)
- The Halogens — Part III: Iodine – Craig Bingman – Aquarium Frontiers (December 1997)
- Iodine in Reef Tanks 2: Effects on Macroalgae Growth – Randy Holmes-Farley – Advanced aquarist’s Online Magazine – (april 2003)
- Reef Aquarium Water Parameters – Randy Holmes-Farley – Reefkeeping – (05-2004)
- Atlas of electrochemical equilibria in aqueous solutions, Marcel Pourbaix – NACE International Cebelcor : 1974
- Strontium et iode en récifal – Alain TORTEY – Ocean Passion On The Road – DVD n°31 (juillet 2010)













Laisser un commentaire