Les dinoflagellés, quel aquariophile en eau de mer n’a pas été ou ne sera pas un jour confronté à ces organismes ? Mystérieux aux yeux de beaucoup, tous les redoutent comme l’une des pestes les plus à craindre parmi les nombreux fléaux. N’ayant pas encore fait connaissance avec le super héro qui dispose de l’arme fatale, je vous livre quelques réflexions et mon expérience.
1. Que sont les dinoflagellés

Il existe de nombreuses communications concernant les dinoflagellés en aquarium, notamment l’excellent article Lutter contre les dinos : identification, état de l’art des moyens de lutte. Aussi je me concentrerai ici sur les aspects pratiques, les moyens de lutte préconisés et mon approche personnelle. Vous pourriez aussi rejoindre le groupe Facebook Mack’s reef…Dinoflagellates support group!. En complément de nombreux témoignages dignes d’intérêts, il permet de se sentir moins seul face à l’un des principaux fléaux de l’aquariophilie récifale..
On peut résumer quelques particularités des dinoflagellés en relation avec leur présence en aquarium marin.
- Omniprésents : Les dinoflagellés sont présents dans les océans où l’on dénombre plus de 2000 espèces de taille 20 à 250 µm. Dans les eaux de surface Ils constituent sous forme planctonique, l’un des principaux producteurs primaires avec les diatomées et les coccolithophoridés. Leurs habitats sont variés : pélagiques et benthiques, pouvant être libres, parasitaires ou endosymbiotiques.
En aquarium il en est de même, introduits via une pierre, une bouture, des algues…
ils ont de multiples occasions d’y être présents. - Photosynthétiques : la moitié des espèces sont photosynthétiques. Injustement appelés microalgues, ces protistes utilisent toutefois l’énergie lumineuse comme source essentielle de leur nutrition. Dans l’océan, il a été démontré que plus que la température, la lumière active la prolifération des dinoflagellés Prorocentrum à l’origine de bloom.
En aquarium l’éclairage est un des leviers les plus efficaces pour leur maitrise. - Résistants : ils supportent de larges variations de conditions environnementales (température, salinité, nutriments).
En aquarium, c’est une des raisons de leur persistance, même quand les conditions sont (revenues) à niveau correct. - Modes de nutrition variés :
- Mixotrophes ils combinent souvent plusieurs modes de nutrition.
- Phototrophes ils utilisent la photosynthèse comme source d’énergie et vivent dans la zone photique proche de la surface (plancton). Certaines espèces sont des symbiotes d’invertébrés marins (ex. les zooxanthelles des coraux).
En aquarium les espèces invasives sont toutes phototrophes. - Phagotrophes ils engloutissent aussi de la nourriture particulaire.
- Hétérotrophes ils ingèrent des particules et diverses proies proches de la surface, des bactéries aux métazoaires.
- Osmotrophes, ils assimilent des composés organiques ou inorganiques dissous tels que l’azote et le phosphore.
- Prédateurs : selon les espèces benthiques ou pélagiques, ils sont consommés par d’autres organismes planctoniques (copépodes benthiques et planctoniques …), quelques invertébrés filtreurs, certaines bactéries, d’autres protistes, les poissons zooplanctonophages et indirectement les organismes broutant le substrat tels que les poissons (chirurgiens, gobies, blennies…) et invertébrés (les gastéropodes notamment les conques, crustacés, échinodermes…)
- Compétiteurs : les algues supérieures et celles qui occupent la même niche écologique (diatomées, cyanobactéries) ainsi que les larves de crustacés, copépodes se nourrissant de phytoplancton. Les dinoflagellés en général, présentent une plus faible affinité d’absorption des nutriments que les diatomées. Ils ont dû mettre en place des adaptations pour faire face à ce désavantage écologique (mixotrophie, allélopathie).
- Toxiques : Certains dinoflagellés (Ostreopsis, Prorocentrum…) produisent des neurotoxines dont la production est biocontrôlée selon la présence de prédateurs. Reconnues par des prédateurs, elles peuvent jouer leur rôle dissuasif. Elles s’accumulent cependant dans les organismes marins qui les ingèrent (mollusques, crustacés, poissons), constituant un danger pour leur santé, comme pour leurs consommateurs (poissons, humains). Chez l’humain l’intoxication peut se manifester par la paralysie, des problèmes neurotoxiques, des amnésies. Nous retrouvons quelques espèces sur nos côtes à l’origine
En aquarium, les brouteurs et limivores : gastéropodes (turbo), echinodermes (oursins, holoturies), poissons (chirurgiens, gobies), peuvent être affectés à des degrés divers jusqu’à leur mort. - Mobiles : leurs deux flagelles permettent d’ajuster leur flottabilité et de nager dans la colonne d’eau dans des mouvements plus ou moins rapides (quelques cm à quelques mètres par heure), parfois saccadés, pivotant ou tournoyant. Ainsi ils peuvent migrer verticalement durant la journée vers la surface pour leurs activités métaboliques et alimentaires et la nuit vers le fond, loin des eaux de surface appauvries en nutriments. En mer, ils occupent généralement une couche d’eau de surface relativement mince et peu profonde.
En aquarium, les espèces mobiles pourront être attirées et détruites par UV. - Reproduction rapide et multiple : elle alterne entre phases sexuées et asexuées, et des stades motiles et benthiques. La reproduction asexuée se fait par mitose : la cellule se divise par fission binaire pour donner deux cellules filles identiques, clones de la cellule mère. Cette reproduction végétative est rapide, de l’ordre d’une division par jour (une cellule produit un demi milliard de cellules en un mois), donnant lieu à des efflorescences (blooms) : les "marées rouges". La reproduction sexuée est souvent initiée par des facteurs abiotiques liés aux changements brusques des conditions environnementales (température, agitation du milieu…) mais aussi par le changement des conditions nutritives (limitation en nutriments à la fin du bloom).
En aquarium,
on retiendra que leur apparition est souvent liée à une dérive de paramètres, notamment une insuffisance de nitrates, et que l’invasion s’acélére à un rythme rapidement difficile à contenir si l’on intervient pas à temps. - Enkystement : Environ 15 % des espèces marines s’enkystent, s’immobilisent et ralentissent alors leur métabolisme. Un moyen de survie et de dispersion de l’espèce. La morphologie de ces dinokystes diffère grandement de leurs états mobiles. Ils forment une enveloppe protectrice, calcaire ou organique, couverte d’épines, de protubérances ou de strates de mucus, mais parfois similaire entre espèces. Les recherches sur les dinokystes ont débuté récemment dans les années 1950 et de nombreux points restent à éclaircir.
- Le kyste temporaire à membrane fine, se forme en quelques heures dans une stratégie de survie dans des conditions de stress particulier (ratio N/P élevé, épuisement des éléments nutritifs, dynamique hydraulique, climat, pollution, compétitions inter-espèces, toxines, pH, température…). Ce kyste peut soit germer (reproduction asexuée) pour donner deux cellules qui entameront leur vie pélagique, soit s’échouer sur le sédiment dans une phase de dormance de quelques jours à plusieurs mois, jusqu’à ce que les conditions redeviennent viables. Le désenkystement massif est à l’origine des efflorescences colorant la surface de l’eau à certaines saisons.
- Le kyste de résistance à paroi épaisse se forme lors du cycle de reproduction sexuée. Il se dépose en général sur les sédiments. Viable de 6 mois à 6 ans il germe ensuite dans des conditions favorables.

En aquarium : cet enkystement peut il expliquer la réapparition tardive des dinoflagellés dans certaines conditions ? Les espèces Ostreopsis et Prorocentrum sont en effet en mesure de s’enkyster. Toutefois il n’existe pas à ce jour de publication traitant de l’apparence de leurs dinokystes, ni sur la rapidité de leur formation, à l’échelle de minutes ou d’heures. Le fait est que je n’ai jamais observé de formes différentes du dinoflagellé parent, quelle que soit l’invasion, sur plusieurs jours, même lors de traitements particuliers (peroxyde d’hydrogène). En l’absence d’informations fiables, l’enkystement dans l’aquarium reste à l’état d’hypothèse. Des migrations pouvant être simplement le fait de l’évolution des conditions ambiantes (nutriments, lumière…) de nature à développer ou régresser leur population, comme on peut l’observer parfois au cours d’une journée.

- Protection : les dinoflagellés possèdent des structures externes, minces et flexibles (thèques) composées de cellulose, de chitine, de silice voire de calcaire.
En aquarium, les espèces habituellement observées ne biominéralisent pas de silice. La présence de silicate dans l’eau ne favorise donc pas leur présence, contrairement à certains chrysophites, autres organismes unicellulaires ciliés de couleur jaune avec lesquels ils peuvent être confondus. - Adhérence : des cellules spécialisées, les mucocystes, produisent des sécrétions sous forme de filaments muqueux leur permettant d’adhérer à tout support et ce, rapidement.
En aquarium il faut renouveler très fréquemment leur décollement du support, dans la colonne d’eau pour favoriser leur évacuation vers la filtration. - Mucilage : les dinoflagellés de 20 à 80 µm dans nos aquariums, s’agglomèrent, agglutinés dans une gangue muqueuse. Ce mucilage aurait un intérêt allélopathique, créant une zone extracellulaire de molécules bioactives. Produit en grande quantité, le mucus piège également des microbulles d’oxygène issu de la photosynthèse, les agrégats migrants ainsi vers la surface sous forme de "fleurs d’eau".
En aquarium, cette allélopathie toxique stresse et affaiblit les coraux alentours. Une pompe peut décoller les cellules libres de dinoflagellés ainsi que leurs agglomérats. Les plus gros agrégats peuvent être récupés avec une épuisette fine, les plus fins retenus par un micron-filtre de maille 100 à 200 µm, l’écumeur se chargeant du reste. - Bioluminescence : non présentes en aquarium, nous ne pourrons nous laisser émerveiller par le scintillement des espèces bioluminescentes dans le sillage d’un courant.
2. Identifier les dinoflagellés
On retrouve a peu près toujours les même genres de dinoflagellés dans nos récifs captifs. Ostréopsis sp., Prorocentrum sp., Amphidinium sp. avec grande ou petite cellules, et plus rarement Coolia sp.
2.1. Suspecter leur présence
Quelques indices permettent de suspecter leur présence :
- Aspect général : En aquarium, les formes baveuses observées sont dues à l’amalgame de dinoflagellés individuels de petite taille 20 à 80 µm dans un mucus plus ou moins visqueux (mucilage). Les photos (figure 5) donnent un aperçu de l’aspect général dans un aquarium.
- Leur apparition est progressive. Le sable (a) se recouvre d’un film fin de couleur jaune pâle à brun, sans grande prolifération de petite bulles gazeuses. On peut le confondre avec des diatomées lesquelles ne dégagent pas d’oxygène.
- Les dépôts s’étendent en films plus épais (mucilats) , visqueux (b) similaires à des cyanobactéries. La présence de petites bulles gazeuses plus prononcée les élèvent à la verticale (fc).
- Ils peuvent aussi s’agglutiner en petits amats plus foncés sur les surfaces (figure 3).
- Les pierres, les algues, les squelettes des coraux, les gorgones, tous les éléments (verre, pompes…) se recouvrent de la même manière (d) créant un environnement toxique par ingestion et diffusion dans l’eau par allélopathie.
- Morts suspectes : signe très révélateur, quelques invertébrés brouteurs meurent (gastéropodes, échinodermes, crustacés…). A un stade plus avancé des poissons herbivores peuvent être suffisamment incommodés par les toxines et développer des maladies (Cryptocarion…) dégénérant en maladies bactériennes pouvant mener à leur perte.
- Les coraux sont atteints : par un mécanisme incertain (toxines, dérangement…) les dinoflagellés stressent les coraux.
- Cela débute par des coraux LPS moins gonflés,
- Puis lentement on constate la décoloration des tissus des SPS et LPS.
- S’ensuit le désépaississement des tissus les plus épais au point de deviner les formes sous-jacentes du corallite (mur, septes…).
- Enfin le tissu se déchire dans les zones les plus acérées du squelette (LPS) (figure 4) ou se desquame rapidement (SPS) sur des zones entières, mettant à jour le squelette. A ce stade ils ne sont plus récupérables.





2.2. Différencier les dinoflagellés d’autres organismes (diatomées, cyanobactéries, chrysophytes…)
La différence n’est pas aisée, le tableau 1 propose quelques tendances pour nos espèces d’aquarium récifal.
| Organisme | Couleur | Film | Apparence | Consistance | Comportement |
|---|---|---|---|---|---|
| Dinoflagellés | Jaunâtres à brunâtres. | Moyen | Filaments avec bulles éparses. Amas isolés. | Poussiéreuse à gluante. | Parfois : libère le substrat et nage en pleine eau la nuit. |
| Diatomées | Jaunâtres à beige. | Fin | Sans bulle. Microscope : bâtonnets |
Poussiéreuse. | Peuvent se libérer dans l’eau. |
| Cyanobactéries | Rouge à vert plutôt foncé. | Epais | Nombreuses bulles grossières. Microscope : longs fils, mêches plus ou moins transparents. |
Très gluant, se détache en nappe du décor. | Peuvent se libérer dans l’eau. |
| Chrysophytes | Dorée | Epais | Filaments longs Celllules petites. |
Duvet | Non toxique. Immobile. Se développent en présence de silicates |
| Euglena | Vert, mat | Moyen | Tapis mat avec bulles sur sable et verre. | Non toxiques. Concurrencés par diatomées. |
2.3. Identifier le genre du dinoflagellé
2.3.1. Microscope indispensable
La seule méthode pour identifier précisément les dinoflagellés est de les observer au microscope. Un modèle scolaire, d’une centaine d’euros, suffit pourvu qu’il ait une netteté acceptable dans des grossissement de l’ordre de 100 à 400X, voire 600X pour d’autres usages. Il faut privilégier un grossissement optique précis à une électronique qui amplifie aussi les distorsions. La nature du mouvement des organismes contribue à l’identification. Pour capturer et partager photo et vidéos, l’optique connectée à un PC est préférable au Smartphone plaqué sur l’objectif, finalement mal maintenu.
Pou l’observation, prélever l’eau ou des fragments de dépôts en divers points de l’aquarium. Déposer et étaler une goutte sur une lame. La pression entre lame et lamelle réduit la mobilité des organismes, aussi je préfère observer sur une lame seule dans le champ de lumière traversant.
2.3.2. Particularités des dinoflagellés
| Genre | Forme, mobilité | Toxine | Fréqu. aquarium | Thèque |
|---|---|---|---|---|
| Ostreopsis | Forme de long filaments sur vitres, décors, coraux. Se libère dans la colonne d’eau le soir. Goutte, ovoïde, comprimée vers l’arrière. Taille ≈ 50µm. Assez mobile, tourne en cercles sur sa pointe (ex. toupie). |
Très forte toxicité : Palytoxine, ovatoxine | Très | Oui |
| Amphidinium AGC, APC |
Arrondie ovoïde ou allongée mais non symétrique avec un bord plus rectiligne, comprimé entre dos et ventre. Plutôt poussiéreux. Deux types : * Amphidinium à grandes cellules (AGC, angl. LCA), avec une fente en V à l’avant et un bec peu visible. Taille ≈ 50µm. * Amphidinium à petites cellules (APC, angl. SCA) 5 fois plus petites, avec un bec en crochet assez marqué. Taille ≈ 10µm. Moyennement mobiles. La cellule pivote sur elle-même selon son axe vertical (auto tamponneuse). S’enfouit dans le sable la nuit. |
Peu toxique : Okadaïnes, dinophysistoxines, pecténotoxines, azaspiracides. | Oui | Non |
| Prorocentrum | Ronde, ovoïde ou cordiforme, symétrique, plus grosse que APC. Peu mobile. Se retourne sur lui-même autour de son axe longitudinal. S’enfouit dans le sable la nuit. Taille ≈ 50 µm. |
Peu toxique : Acide okaidaïque, amphidinols | Oui | Oui |
| Coolia | Rond à ovale. Filaments courts, en nappe, sur le sable. Assez mobiles, se déplace sur un plan (ex. voiture). Se libère dans la colonne d’eau le soir. Taille ≈ 20µm. | Moyenneemnt toxique : Cooliatoxines. | Rare | Oui |




3. Pourquoi les dinoflagellés sont là ?

Les dinoflagellés sont introduits via les boutures, roches vivantes, algues, l’eau de mer naturelle, une nourriture avariée, des accessoires… Ils sont présents, enkystés ou bien à un niveau tel que la santé des organismes de l’aquarium permet d’y faire face. La meilleure prévention contre leur développement est incontestablement une maintenance équilibrée, avec les nutriments (N, P…) indispensables.
Quoi qu’il en soit une dérive peut toujours se produire, même chez les plus aguerris des récifalistes. Elle a d’ailleurs probablement eu lieu puisque vous voilà ici. Le développement des dinoflagellés débute plusieurs semaines ou mois avant même qu’on le détecte et qu’il atteigne un niveau inquiétant. A raison d’un doublement de la population chaque jour on a tout intérêt à agir vite. Quelques milliers de cellules alors peu visibles sur le décor se nombrent à 2 milliards 15 jours plus tard (figure 8). Plusieurs facteurs ont pu le favoriser :
3.1. Insuffisance de nutriments
Cette situation semble la cause la plus fréquente de l’apparition des dinoflagellés. Les dinoflagellés, en mesure de stocker des nutriments, notamment certaine formes thécales (Ostreopsis, Prorocentrum…), sont adaptés à un environnement oligotrophe. Ainsi ils prennent l’ascendant (comme les cyanobactéries) quand les bactéries utiles au cycle de l’azote et dans une moindre mesure celui du phosphore se réduisent. C’est à dire avec des taux de nitrates ou de phosphate trop bas, trop longtemps, et particulièrement si ce taux s’inverse. Par exemple dans les cas suivants :
- Démarrage avec des pierres inertes : c’est une situation rencontrée fréquemment lors des démarrages avec des pierres inertes, l’équilibre de l’azote s’installant plus difficilement. Il est parfois nécessaire, pour y remédier de réaliser des apports de nitrates réguliers. L’ensemencement initial d’un aquarium est une phase cruciale, il est vivement conseillé d’introduire un minimum de roches vivantes saines, colonisées en bactéries et méiofaune.
- Trop d’épuration :
- Mécanique : micron filtres, filtres papier trop efficaces
- Physique : écumeur suractif dont on peut réduire la période de fonctionnement, changements d’eau trop fréquents,
- Chimique : médias de filtration (ferriques).
- Biologique (réacteurs à bactéries, refuges algaux qui consomment trop de nutriments…).
- Alimentation inadaptée (quantité, fréquence) : les aliments ont des valeurs nutritives très inégales et plus ou moins consommés à chaque repas. Les granulés sont par exemple bien plus protéinés que les surgelés, certaines marques sont surdosées en phosphore. L’aquariophile a du mal à évaluer le besoin alimentaire de ses protégés, et juger la ration d’un aliment sec à 50 % de protéines face à sa propre recette chargée à 20 % de protéines et gorgée de 70 % d’eau. La crainte de polluer peut se traduire par une sous-alimentation certes encore suffisante pour les poissons mais pas pour les équilibres biologiques, surtout quand un refuge algal vient impacter les consommations.
- Ratio N/P : une étude en milieu naturel a montré qu’un faible taux de phospore associé à un ratio N/P élevé favorise le développement des dinoflagellés au détriment des diatomées.
3.2. Environnement physique favorable
Tous les paramètres d’un aquarium récifal visent à maintenir les habitants en bonne santé, en mesure de lutter contre les agressions des organismes pathogènes. La dérive de n’importe lequel, qu’il soit physique (lumière, brassage…) ou chimique (qualité de l’eau, équilibre ionique, carence ou excès de certains oligoéléments…), contribue à affaiblir les invertébrés les plus fragiles et devient un facteur de prolifération des dinoflagellés, plus résistants aux conditions extrêmes.
3.3. Environnement biochimique favorable
- Excès de nutriments : La croissance des dinoflagellés s’accélère en présence de nutriments NO3 et PO4 dissous en excès dans l’eau. Cet excès peut résulter de pollutions ou d’une gestion de l’eau inadaptée. Toutes les fonctions du cycle de l’azote et du phosphore sont alors en jeu. La situation impose une remise en question de chaque processus de la maintenance.
- Déséquilibre microbiologique : par exemple avec une insuffisance d’organismes (bactéries, diatomées…) compétitrices pour les nutriments. Quand les nitrates et les phosphates chutent à des niveaux extrêmement bas, la population de bactéries bénéfiques se réduit, offrant une opportunité aux dinoflagellés de les supplanter.
- Peu de prédateurs : une faible population de prédateurs naturels cités plus haut ne permet plus de réguler leur croissance.
- Effets des silicates : le monde de l’aquariophilie récifale impute parfois le développement des dinoflagellés à la présence de silicates dans l’eau. Certes, quelques espèces, relativement marginales, assimilent directement du silicium, mais pas celles de nos aquariums. Le taux de silicium n’explique donc pas la prolifération de dinoflagellés. Bien au contraire, comme on le verra, les diatomées occupant la même niche biologique que les dinoflagellés, elles sont concurrentes. L’augmentation de la population des diatomées se fera au détriment des dinoflagellés.
4. Eliminer les dinoflagellés
4.1. Plan d’action
Les actions doivent être menées sans tarder pour éviter le stade des décès et nécroses de coraux, à répétition. Le plan s’inscrit dans une démarche longue avec un investissement quotidien. Les effets visibles ne sont pas immédiats, il est fort probable que ce combat soit semé d’incertitudes avec une exaspération qui ne doit laisser aucune place à la démotivation. C’est là le plus grand danger de notre envahisseur. Eliminer les plus fortes invasions de dinoflagellés est poutant possible. Bien placé pour l’écrire, je vous encourage à ne jamais abandonner.
| Ostreopsis | Prorocentrum | Amphidinium | Coolia | |
|---|---|---|---|---|
| Eradication | Facile | Très difficile | Difficile | Facile |
| NO3, PO4 | Mettre et maintenir à niveau | |||
| Nettoyer | Nettoyer les décors, filtrer, écumer | |||
| Filtre UV | OUI | NON | NON | OUI |
| Balai UV | En partie | OUI | OUI | OUI |
| Bactéries | OUI | |||
| Obscurité | OUI | NON | NON | OUI |
| Méiofaune | OUI | |||
| Silicate | NON | OUI | OUI | NON |
| Charbon actif | OUI | NON | NON | OUI |
Bien qu’il n’existe pas de recette universellement admise, il est impératif d’engager toutes les actions possibles parmi les suivantes :
- Maintenir une eau équilibrée
NO3 et PO4 équilibrés et relativement élevés : C’est une étape primordiale. Les bonnes bactéries en concurrence avec les dinoflagellés ont besoin de nutriments pour prospérer et prendre le dessus.
- Tester : dans la période d’éradication les taux devraient respecter NO3 > 10 ppm et PO4 entre 0,07 et 0,15 ppm pour se stabiliser ensuite avec PO4 > 0,05 ppm dans un ratio NO3/PO4 environ 100 à 150. Le photomètre PO4 Hanna ULR semble affecté et imprécis en présence des taux importants d’un éventuel traitement aux silicates.
- Supplémenter en nitrates si besoin avec des additifs commerciaux de type NO3+ et PO+4 ou DIY (nitrate de calcium ou de potassium). L’apport quotidien est ajusté selon les résultats des tests. Cette méthode, adaptée à la consommation du bac, présente l’avantage d’éviter les contraintes liées aux modifications de filtration et d’alimentation.
- Réduire la filtration mécanique : si elle devait s’avérer trop efficace (filtre papier…), pour remonter NO3 et PO4.
- Nettoyer les filtres quotidiennement voire plus souvent. Bien que nos dinoflagellés ne mesurent que de 20 à 80 µm, vous observerez qu’un filtre 200 µm se colmate très vite par les cellules fréquemment agglomérées. Les filtres en maille polyester sont appréciés ici, plus facile à nettoyer que ceux en intissé polypropylène.
- Ecumer : laisser fonctionner l’écumeur pour éliminer au maximum les cellules mortes ou vivantes et, si besoin, réduire sa durée de fonctionnement pour remonter les niveaux de nutriments. Je n’évoquerai pas le réglage clair ou foncé de l’écumeur qui ne correspond qu’à un niveau de dilution des matières organiques extraites, sans étude sérieuse sur l’efficacité de tel ou tel réglage.
- Nourrir plus : avec des aliments concentrés en protéines (granulés) contribue à générer des déchets et remonter les taux de NO3 et PO4. S’assurer par des tests réguliers que cela n’affecte pas l’équilibre entre les deux valeurs.
- Arrêter les traitements : les oxydes ferriques ou d’aluminium absorbent trop les PO4 ; le réacteur à bactérie et les apports de carbone (NoPox, acides aminés, sucres, alcools…) augmentent l’activité bactérienne contribuant à la réduction de N et P.
- Éliminer les dinoflagellés quotidiennement.
- Dégager les dinoflagellés du décor, des vitres et des équipements avec une pompe à eau puissante. Le cellules se détachent très facilement, malheureusement elles se fixent tout autant. D’où l’intérêt de répéter l’opération. Les plus gros agglomérats peuvent être ramassés à l’épuisette fine.
- Nettoyer le pierres : éliminer autant que possible les algues envahissantes, gazons, favorisant l’accrochage et le développement des dinoflagellés, avec une brosse à dents ou à récurer (figure 9). Une alternative contraigante pour éliminer drastiquement la population consiste à brosser chaque pierre, en dehors de l’aquarium, suivi d’une rapide douchette à l’eau douce (les dinos sont évacués en masse) puis retour immédiat dans l’eau du bac. L’essentiel des microrganismes survit. Les coraux seront épargnés. Cette solution est rendue plus facile si on a pris le soin de réaliser un décor amovible et des socles de boutures démontables. Ces opérations fastidieuses et décourageantes quand les dinos réapparaissent le lendemain, sont cependant efficaces, leurs effets sont perceptibles après quelques jours. Les actions pour contenir leur population doivent être maintenues.
- Siphonner la couche superficielle du sable, lumières allumées, les dinoflagellés étant alors plus abondants. L’eau prélevée peut être réinjectée après décantation et passage dans un micron-filtre. Le sable peut être fortement brassé sous l’eau douce du réseau, puis trempé une heure dans l’eau oxygénée et enfin rincé avant retour dans la cuve où il sera recolonisé par les bactéries du sable sous-jacent. L’eau de mer pourra être filtrée comme ci-desous et recyclée vers l’aquarium.
- Utiliser des micron-filtres et les nettoyer quotidiennement, le plus souvent possible et très fréquemment lors des nettoyages du décor. L’objectif est d’éliminer le plus de dinoflagellés, constamment. La logique recommanderait une maille de 20 µm. Dans la pratique une telle finesse se colmate en quelques minutes. Les dinoflagellés qui s’agglutinent en agrégats beaucoup plus importants sont retenus par une maille d’environ 100 µm. Vous constaterez que cette dernière se colmate déjà rapidement. L’écumeur en aval pourra terminer le travail.
- Stérilisateur UV-C pour l’eau
- Traiter l’eau au stérilisateur UV en présence des espèces qui occupent la colonne d’eau la nuit (Ostreopsis, Prorocentrum…)
- Correctement, voire surdimensionné : en général, l’UV doit d’une part traiter tout le volume d’eau, et d’autre part permettre un temps d’irradiation suffisant pour détruire les parasites. Ainsi il doit respecter à minima les deux conditions :
- Traiter de 2 à 3 fois le volume d’eau par heure : Débit UV (l/h) > 2 x Vol. (l). Attention, ce débit n’est pas celui de la pompe mais le débit réel, mesuré en sortie, compte tenu des pertes de charges (longueur UV, tuyauterie, coudes…).
- Puissance adaptée à ce débit : Puissance UV (W) > Débit (l/h) / 40.
- Placer l’UV de préférence au plus proche de l’infestation, c’est à dire aspirer de préférence près du lit de sable.et refouler dans l’aquarium.
- Attirer les dinoflagellés libres au moyen d’une lampe éclairée la nuit, placée à l’entrée de l’UV.
- Poursuivre l’UV 2 semaines après la disparition d’Ostreopsis ou Coolia.
- La durée de vie d’une lampe UV est d’environ 10000 heures, mais perd 75% de ses radiations UV après 6 mois de fonctionnement 24h/24h, soit 4300 heures ou 480 nuits de traitements.
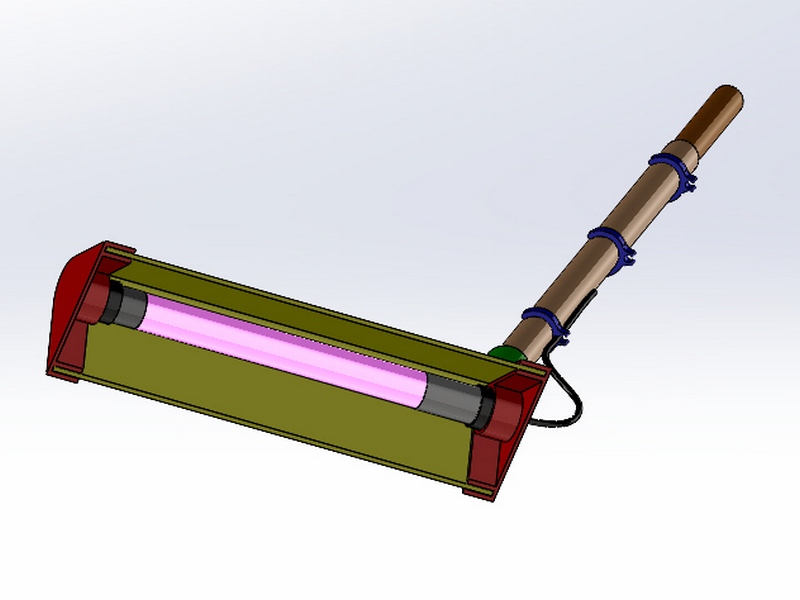
- Stérilisateur "balai UV-C" pour le sol. Le principe consiste à déplacer une lampe UV-C sur le sol en étapes de quelques minutes. Le principe et le "balai UV" utilisé sont détaillés dans l’article Balai UV germicide DIY. Cette méthode encore peu utilisée semble prometteuse pour contribuer à réduire rapidement et efficacement la population des espèces se regroupant sur le fond durant l’éclairement.
- Entretenir la population bactérienne : il s’agit de créer une compétition pour les nutriments avec les dinoflagellés. Les bactéries agissent sur les cycles de dégradation et les nutriments disponibles. De plus, certaines bactéries sécrètent des substances (enzymes, composés antimicrobiens) en mesure de créer un environnement défavorable et d’inhiber la croissance des dinoflagellés.
L’article Bactéries en aquarium marin et récifal développe les différents aspects relatifs aux bactéries énnoncés ci-dessous :
Etablir un spectre bactérien par l’ajout de quelques pierres vivantes issues d’une source sûre ; un mélange de bactéries provenant de plusieurs marques sérieuses afin d’augmenter les chances d’introduire des espèces réellement bénéfiques. Sans marque à conseiller, je pencherais vers des assemblages de bactéries d’eau de mer, consommatrices d’azote et de phosphore, incluant des enzymes.
Développer la densité de bactéries Cependant, ces ajouts quotidiens peuvent impacter les nutriments qu’il faut continuer à mesurer.
Augmenter la densité bactérienne par des ajouts de composants carbonés (acides aminés, NO3:PO4-X…) selon les taux de No3 et 3Po4 mesurés. Voire provoquer un ajout massif de pré-culture bactérienne de manière à contrecarrer l’invasion. - Réduire la quantité de lumière : cela ne résoud pas l’épidémie mais y contribue très fortement (figure 10).
- Réduire la photopériode par exemple de 10 heures à 6 heures par jour.
- Réduire l’intensité autant que possible (50 %, voire plus) de tous les canaux bleus et blancs. En effet, à la profondeur de l’aquarium, la photosynthèse exploite toutes les longueurs d’ondes du spectre utilisées par les chlorophylles a, b et les caroténoïdes, de 400 à 500 nm et 600 à 700 nm.
- Obscurité 3 jours : si possible réaliser un black-out qui ralentira efficacement la croissance des dinoflagellés photosynthétiques. Cette opération peut signer le renversement de la bataille en notre faveur. La cuve doit alors être emmaillotée, voire totalement recouverte, dans un matériau opaque. L’éclairage est éteint mais le brassage, les échanges gazeux et la température sont maintenus. Ces 3 jours d’obscurité ne nuiront pas aux coraux s’ils ne sont pas déjà affaiblis, sinon simplement réduire la lumière. A la reprise de l’éclairement des dinoflagellés réaparaitront normalement, mais le plan d’actions doit se poursuivre.
Si le black-out permet de réduire notablement
la population visible, il s’avère que les cellules ressurgissent pour reprendre leur développement. Des tentatives d’obscurité plus longues jusqu’à 7 jours n’ont pas permis d’éradiquer les dinoflagellés. Au-delà le risque pour les coraux augmente dangereusement. Cette méthode est plus à considérer comme un moyen de réduire la densité pour faciliter les autres types d’actions tels que le nettoyage, les UV ou un traitement aux silicates. - Développer les diatomées concurrentes par ajout de silicates : la silice, issue des silicates, nécessaire à la formation de leurs frustules favorise leur prolifération jusqu’à supplanter les dinoflagellés. Contrairement à ces derniers, les diatomées ne présentent pas de risque toxique pour les organismes marins. Les décors se recouvriront d’un voile brun durant le traitement, mais les diatomées disparaitront après la consommation du silicium, en partie évacuées par l’écumeur. Suivre les dosages ci-après.
- Développer la micro-méiofaune par implantation de souches (rotifères, copépodes, amphipodes…) et l’entretenir par ajout de phytoplancton. Etant intoxiqués par ingestion des dinofflagellés, il faut impérativement assurer des apports de phytoplancton (diatomées et autres espèces) pour renouveler leur population.
- Implanter des brouteurs : les gobies (Valenciennea puellaris) nettoient le sable. Les gastéropodes de grande taille (conque, turbo…) s’avèrent efficace. Cette solution ne s’applique pas en présence de forte invasion de dinoflagellés toxiques tels qu’Ostreosis, leurs toxines s’accumulant dans l’organisme peuvent conduire à la mort.
Oligoéléments équilibrés : L’équilibre chimique de l’eau impose, bien entendu, l’utilisation d’eau osmosée.correctement reminéralisée. Certains oligoéléments en carence ou en excès (B, Br, I, Mo, V, Zn) inhibent le développement des algues, des bactéries, des dinoflagellés et de bien d’autres organismes. C’est l’occasion de les ajuster si besoin après une analyse ICP.
Charbon actif : limiter l’utilisation du charbon acif, à environ 50 g / 200 l, aux seuls dinoflagellés toxiques (ostreopsis, Coolia) afin de ne pas adsorber trop d’oligoéléments, notamment l’iode. Il faudra alors le renouveler, au moins partiellement, toutes les semaines.
Exemple pour 1000 litres d’eau : Débit réel > 2 x 1000 = 2000 l/h ; Puissance UV > 2000 / 40 = 50 Watt (ex. UV 72W ou 2 x UV 36 W en série)
Dans le cas des dinoflagellés ne pas hésiter à aller au-delà de ces préconisations.

En fin de traitement, s’attacher à conserver une eau de qualité récifale avec les nutriments nécessaires et maintenir une forte biodiversité (bactéries, microfaune, meiofaune, détritivores…). C’est la meilleure garantie contre une récidive.
4.2. Traitements chimiques
En général quelques actions parmi celles déjà citées sont efficaces. Il existe également des traitements chimiques, seuls ou en complément des actions précédentes, commerciaux ou DIY, dont l’efficacité reste cependant limitée à quelques commentaires et souvent à froid.
Par exemple :
4.2.1. Peroxyde d’hydrogène
L’article Peroxyde d’hydrogène H2O2 en aquariophilie récifale détaille les différents usages de H2O2 notamment comme désinfectant.
Traitement habituelllement préconisé :
- Dosage : 2,7 ml H2O2 à 3% (10 Vol) par 100 litres par jour, ou 3 fois moins 0,9 ml H2O2 à 9% (30 Vol). Nota 2,7 ml/100 l = 1 ml/10 gal = 0,0027%.
- Traiter une heure après l‘extinction de l‘éclairage du bac (l’activité photosynthétique s’arrête, le produit est plus efficace
- Verser lentement, dans un courant important, idéalement devant la pompe de remontée.
- Durée : 5 jours.
Ce très faible dosage ne présente pas de risque de manipulation et ne nuit pas aux organismes. Malheureusement les observations au microscope montrent que ce dosage est inefficace sur les dinoflagellés, quels qu’ils soient. On ne relève aucune mortalité. Il faut le considérer plutôt comme une contribution à l’assainissement général.
Lorsque qu’il devient inévitable, en dernier recours, on peut augmenter la dose affain d’atteindre les dinoflagellés sans nuire à la méiofaune ni trop déséquilibrer le fonctionnement de l’aquarium. L’eau oxygénée à 10 volumes (3%) peut être dosée à 0,10 % dans l’aquarium communautaire selon le protocole détaillé dans l’article Dinoflagellés, traitement de l’aquarium récifal à l’eau oxygénée.
4.2.1. Silicates
Traitement
Le traitement consiste à injecter de la silice sous forme de silicate pour favoriser la prolifération de diatomées jusqu’à disparition des dinoflagellés. Le silicate de sodium utilisé se présente sous deux formes :
- Liquide : il s’agit d’une solution aqueuse de silicate de sodium (Na2O SiO2 H2O), également appellé verre liquide (angl. water glass), composée de dioxyde de silicium (SiO2) et d’oxyde de sodium (Na2O), dans un rapport molaire SiO2/Na2O variable qui impacte sa viscosité. La solution utilisée est en général à 40 % d’extrait sec (Na2O SiO2).
Dans un rapport molaire 3,4 elle contient 28 % de silice SiO2, soit 280 g SiO2 / l de solution. Le produit se trouve en VPC. - Solide : en granulés translucides, il s’agit en général de métasilicate de sodium pentahydrate Na2SiO3.5H2O, ou éventuellement nonahydrate Na2SiO3.9H2O, totalement soluble dans l’eau osmosée. Le rapport molaire SiO2/Na2O est beaucoup plus faible, avec 28,8 % de silice SiO2 pour l’hexahydraté, soit 288 g SiO2 / kg, et 21,1 % pour le nonahydraté, soit 211 g SiO2 / kg. Le produit se trouve en VPC.
Ce calculateur permet de définir le dosage du produit utilisé selon le volume de l’aquarium.
Mode opératoire :
- Peser le produit silicaté (liquide ou solide) selon le tableau 4, pour atteindre au début de 2 à 3 mg/l silicates.
Par exemple, selon le tableau ci-dessus il faut 0,3 ml de silicate de sodium en solution 38-40% pour augmenter 1 mg/l SiO2 (1 ppm) dans 100 litres de l’aquarium. Les organismes ne sont pas affectés par une concentration même supérieure. - Diluer dans environ 1/4 litre d’eau osmosée impérativement, remuer et agiter.
- Verser la dilution lentement dans un fort courant, idéalement dans la cuve technique en amont de la remontée.
- Tester au colorimètre. Le test Colombo Marine Silicate test SIO2 serait relativement plus fiable que Salifert. SI Profi test Silicate.
L’ajout de silicate influence la mesure au photomètre. Avec photomètre, tester au-delà de 24h après ajout de silicate.
Surveiller l’absence d’augmentation de l’alcalinité (KH) le sodium pouvant former des carbonates de sodium en présence de CO2 - Recommencer chaque jour au point 1 pour maintenir 1mg/l durant plusieurs semaines/mois.
- Les supports se couvrent d’un tapis de diatomées, sans danger pour les organismes.
- Arrêter le traitement quand les dinoflagellés ne sont quasiment plus détectés au microscope.
- Le taux de silicate descendra et s’équlibrera à un taux normal avec la disparition des diatomées.
4.2.2. Permanganate de potassium
Contre les dinoflagellés et les cyanobactéries, A.Thiel préconise une solution à 10% de permanganate de potassium (1g KMnO4 par litre d’eau osmosée) utilisée à 5 ml par tranche de 100 L d’eau du bac toutes les 3 heures soit 5 fois par jour durant 4 à 5 jours. Son pouvoir oxydant sur les matières organiques est observable sur le potentiel redox. Il s’agit là d’une méthode curative pour stopper provisoirement l’invasion, à ne pas renouveler souvent ni surdoser au risque de dégâts irréversibles.
4.2.4. Produits commerciaux
Fauna Marin Dino X : est efficace avec certaines espèces de dinoflagellés. Son action, plutôt rapide n’épargnerait pas certains invertrébrés (oursins…). Si des utilisateurs semblent satisfaits, d’autres regrettent la réapparition des dinoflagelllés dans les 2 à 3 semaines qui suivent.
Egalement : Fauna Marin Ultra algae X, Fluconazole, API Algae fix. Le Vibrant souvent cité ne serait pas efficace durablement selon de nombreux témoignages.
5. Mon expérience
Une première invasion de dinoflagellés Ostreopsis sp., toxiques, a duré, une grande partie des brouteurs (gastéropodes, étoiles de mer, oursins…) sont morts. Des poissons ont aussi péri : un Saliaras fasciatus et un Acanthurus nigriscens de belle taille affaibli au point de se laisser anéantir par une invasion de Cryptocarion. L’UV a été salutaire. Ostreopsis a disparu des observations au microscope effectuées deux mois plus tard.

Une seconde invasion de dinoflagellés, cette fois-ci Porocentrum sp., s’est répandue à une vitesse fulgurante sur l’ensemble des substrats (sable et pierres). Je n’ai pas réagi assez vite, ma réflexion à ce stade portant plutôt sur l’arrêt du récifal. De nombreux coraux déjà affaiblis on succombé, les dinos s’accrochant à n’importe quelle branche, sur les squelettes nus, ou s’accumulant sur les plateaux. A ce stade les ICP étaient corrects de petites dérives d’oligoéléments vite ajustées.
Mes actions ont porté sur :
- Réduction de l’éclairage durant 5 jours soit 50 % de puissance et photopériode passée de 10 h à 6 h.
- Grattage des pierres pour évacuer une algue gazonnante qui retenait les dinos. Grattage de la vitre arrière pour les mêmes raisons.
- Nettoyage quasi quotidien des pierres à la pompe à eau.
- Siphonnage, nettoyage et désinfection du sable en surface selon le protocole plus haut, tous les deux jours au début, puis deux fois par semaine plus tard.
- Nettoyage plusieurs fois par jour des micron-filtres
- Pose d’un UV dans l’aquarium par acquis de conscience.
- Un black-out de 3 jours a contribué à nettement améliorer la situation, avec un sable quasi immaculé.
Il y a eu finalement une amélioration très progressive, tout juste perceptible au delà de 10 jours. Après un mois et demi le sable a retrouvé sa blancheur et le décor sa clarté, des signes de croissance tissulaire sur les LPS, des couleurs de SPS plus soutenues.
- Les dinoflagellés ont malheureusement repris leur progression avec l’augmentation progressive de la lumière, pour retrouver un stade innaceptable.
- Un traitement silicate, au métasilicate de sodium pentahydrate, a été efectué sur 10 jours. L’invasion de diatomées a rendu le bac marron sans observer par ailleurs d’amélioration probante. J’ai définitivement abandonné les silicates, en ne poursuivant que les opérations de nettoyage (pompe dirigée vers le décor puis siphonage superficiel du sable.
- J’ai testé 2 mois plus tard le "balai UV" très prometteur après traitement quotidien sur une semaine. Un bon moyen d’alléger la charge des dinoflagellés sur les coraux qui reprennent vie, en même temps que l’ensemble du bac. Ce sera le moyen le plus rapidement efficace contre les dinoflagellés benthiques, je l’ai décrit dans l’article Balai UV germicide DIY.
- Pourtant le balai n’a jamais permis d’éradiquer totalement les dinoflagellés. Ostreopsis restait présent et Prorocentrum revenaient. Il fallait une action relais, biologique. Mais le développementb de diatomées était sans effet, et je n’ai pas su trouver les espèces de copépodes prédatrices des dinoflagellés. Je n’ai pas pu trouver à temps la méiofaune permettant de compléter la chaine alimentaire.
- Comme l’ajout de bactéries relatés efficace sur les forum US est resté sans effet chez moi, j’ai supposé que les nutriments présents n’étaient peut être pas suffisants pour contrecarrer les envahisseurs. C’est alors que j’ai introduit massivement des bactéries pré-cultivées. J’en expose le protocole dans l’article Bactéries en aquarium marin et récifal. J’ai vite compris que c’était le chaînon manquant dans mon arsenal quand j’ai vu les dinoflagellés se réduire, autant sur le sol que le décor. Le sable et les roches devenaient chaque fois plus propres et les nettoyages des filtres moins fréquents.
- Entre temps, les observations au microscope m’ont permis de mieux cerner les actions les plus efficaces :
- Contre Ostréopsis : Nettoyage du décor à la pompe tous les 2 jours ; 10% de l’éclairage durant 3 jours ; stérilisateur UV dans l’eau et ajout de culture bactérienne durant 7 jours.
- Contre Prorocentrum : Balai UV tous les jours en insistant de 2 à 10 minutes et ajout de culture bactérienne durant 7 jours.
Le bac a ainsi finalement été débarassé de ces foutus envahisseurs en une dizaine de jours.
Bon courage à vous !
En savoir plus
- Lutter contre les dinos : identification, état de l’art des moyens de lutte, Cap récifal – 12/2020
- Étude Taxonomique et Écophysiologique des dinoflagellés toxiques du Golfe de Gabès: Alexandrium minutum, Prorocentrum lima, Coolia spp. & Ostreopsis ovata, M. Abdennadher – Université de Sfax, Faculté des Sciences, (Tunisie, 03/2024.
- Caractérisation chimique des exsudats du dinoflagellé marin toxique Alexandrium catenella et de la diatomée marine Skeletonema costatum et étude de la réponse protéomique d’Alexandrium catenella en conditions de stress métalliques, Faouzi Herzi – Sciences agricoles. Université de Toulon; Faculté des sciences de Bizerte (Tunisie), 2013. Français.
- Impact de la température sur la biogéographie et la phénologie des dinoflagellés benthiques toxiques du genre Ostreopsis en Méditerranée et en Atlantique, Kévin Drouet – Laboratoire d’Océanographie de Villefranche, 12/2020
- Le phytoplancton des eaux marines libanaises et du Bassin Levantin, Sami Lakkis – Biologie, Biodiversité, Biogéographie – 2018
- Problem Dinoflagellates and pH, Reefkeeping 11/2006
- Étude du cycle de reproduction et de la diversité génétique spatio-temporelle chez le dinoflagellé toxique Alexandrium minutum, Aliou Dia – Thèse, HAL Open Science, 03/2014.
- Towards an Ecological Understanding of Dinoflagellate Cyst Functions, Isabel Bravo, Rosa Isabel Figueroa – Microorganisms, 01/2014
- Diatom-dinoflagellate succession in the Bohai Sea: The role of N/P ratios and dissolved organic nitrogen components , Xiansheng Zhang, Water Research Vol. 251, 03/2024, 121150
















Laisser un commentaire