Impliqué dans de nombreux processus biologiques des organisme vivants, le rôle du magnésium (Mg) est encore mal connu en aquariophilie récifale. Il est indispensable aux organismes calcificateurs : coraux constructeurs du récif (SPS), algues calcaires (corallines, halimeda…), gastéropodes dont les bivalves (bénitier…). Son autre intérêt est de réduire le risque de précipitation du calcium et des carbonate en les maintenant disponibles aux organismes que nous hébergeons. xxxxxx Consommé et également précipité il doit être régulièrement compensé. Cet article résume les différents aspects : la nature du magnésium, ses provenances, ses effets sur le maintien du calcium et des carbonates, sa mesure, son extraction
Dans les océans
Aspects chimiques
Avec en moyenne 1285 mg/l le magnésium est, après le sel et les chlorures, l’ion le plus présent dans l’eau de mer. Il représente en masse trois fois plus que le calcium à 420 mg/l.
Le magnésium est présent dans l’eau de mer sous forme d’ion Mg2+, avec deux charges positives, comme le calcium Ca2+. Ses ions sont libres, associés à environ 8 molécules d’eau. 10 % sont liés à d’autres molécules : sulfate MgSO4, bicarbonate MgHCO3+, carbonate MgCO3, fluorure MgF, borate MgB(OH)4+ et hydroxyde MgOH+. Ce taux est faible mais suffisant pour interagir dans de nombreuses réactions chimiques dans l’eau de mer.
C’est par exemple le cas avec le carbonate : lié ioniquement au magnésium il devient plus stable. Les précipitations sont ralenties et le il supporte des concentrations beaucoup plus élevées sans précipiter. Cet aspect est particulièrement intéressant dans le milieu réduit d’un aquarium, comme on le verra.
Aspects biologiques
La concentration de magnésium dans les organismes, les tissus, est à peu près proportionnelle à celle de l’eau de mer, indépendamment de ce que le squelette contient. On peut l’expliquer par l’importante disponibilité de cet élément dans l’eau de mer et la capacité des organismes à le concentrer.
Le magnésium est crucial pour de nombreuses fonctions biologiques :
- Calcification : elle représente l’essentiel du magnésium assimilé par les coraux hermatypiques. Il pénètre en lieu et place du calcium, sans que l’on sache si le corail maitrise cette substitution ou s’il la subit. On lui attribue le rôle du contrôle de la calcification en empêchant la précipitation rapide du carbonate de calcium.
D’une manière générale chez tous les organismes calcificateurs, la quantité de magnésium qui pénètre dans les éléments bio minéralisés (squelettes, coquilles…) de carbonate de calcium est en relation avec le taux de magnésium de l’eau. Elle varie cependant selon les espèces suivant l’environnement et des facteurs biologiques. Par exemple la matrice organique du squelette en affecte la concentration lors de la calcification. On mesure de 0,05 % à 4,4 % de magnésium chez les coraux scléractiniaires, les gastéropodes (bénitiers…), les algues calcaires (corallines) et les crustacés. - Régulation enzymatique : Le magnésium (Mg) joue un rôle crucial dans la régulation enzymatique des coraux. Il agit comme un cofacteur pour de nombreuses enzymes impliquées dans le métabolisme cellulaire. En particulier les enzymes qui catalysent des réactions impliquant l’ATP (adénosine triphosphate), la principale source d’énergie des cellules. Il stabilise les molécules d’ATP et permet leur utilisation efficace dans les processus énergétiques.
- Synthèse des pigments : Le magnésium est un composant de la chlorophylle dans les algues symbiotiques (zooxanthelles) vivant dans les tissus des coraux. Ces algues effectuent la photosynthèse et fournissent des nutriments essentiels aux coraux. Une carence en magnésium pourrait donc affecter la santé des zooxanthelles et, par conséquent, celle des coraux.
- Maintien de l’équilibre ionique : Le magnésium contribue à l’équilibre ionique et à l’osmolarité des cellules coralliennes. Il participe à la régulation des gradients de concentration d’autres ions, comme le calcium crucial pour la formation du squelette calcaire des coraux.
Le taux de magnésium dans l’eau de mer représente une réserve largement suffisante pour couvrir les besoins métaboliques quotidiens des coraux et autres organismes marins. Cette concentrations élevée permet aux coraux de calcifier efficacement et de maintenir leurs fonctions physiologiques essentielles sans être limités par la disponibilité de ces ions, assurant ainsi un environnement stable et propice à leur croissance et à leur santé.
En aquarium marin et récifal
Le magnésium limite la précipitation du calcium et des carbonates
La précipitation dans l’eau du calcium et carbonate en carbonate de calcium CaCO3 a pour effet de réduire la dureté carbonatée KH et avec elle le risque de voir le pH chuter à niveau inacceptable pour les métabolismes.
Pour mémoire, la précipitation du CaCO3 dans l’eau de mer s’initie de plusieurs manières : dès que le calcium ou le carbonate dépasse son seuil de saturation ; quand le pH est élevé, le bicarbonate se convertit alors en carbonate, sa concentration augmente ; une élévation de température diminue la solubilité du CaCO3 en plus de changer l’état du bicarbonate en carbonate. Une fois amorcée, cette précipitation se poursuit. Ceci, dans l’aquarium ou dans des zones localisées.
Pour l’expliquer succinctement… le magnésium, sous forme carbonate de magnésium Mg(CO3) très facilement soluble et disponible, attiré par les ions carbonates déjà liés au calcium, inhibe la formation naissante de cristaux de CaCO3. Dans la couche superficielle saturée de carbonate de calcium et magnésium CaMg(CO3)2 ou dolomite, la nucléation de Ca et carbonates devient difficile. La réaction est ralentie à un niveau tel qu’il n’existe plus de risque de précipitation en aquarium.
Cet aspect prend une importance particulière dans le milieu confiné de l’aquarium où les dérives sont omniprésentes.
Les liaisons ioniques entre magnésium et carbonates, améliorent donc la stabilité de ce dernier. De manière considérable, le magnésium limite les risques de précipitation en même temps qu’il la ralentit. Ce faisant le magnésium permet de maintenir calcium et carbonates à une plus haute concentration. L’effet tampon pH s’accentue et permet de le maintenir le pH à niveau plus élevé 8,0 à 8,5 et de manière plus stable, notamment durant les fluctuations diurnes et nocturnes.
On le comprend, le magnésium a un impact important sur l’équilibre biologique et chimique de l’aquarium. dans l’aquarium, le maintien du taux dans une plage normale suffit largement aux besoins des réactions et des métabolismes. Des variations de l’ordre de 30 mg/l ne sont pas un problème et les différents apports permettent normalement de compenser les consommations. Il en va autrement quand on réduit les apports par des changements d’eau peu fréquents (supérieur à 6 mois). Un appauvrissement progressif s’installe et impose de supplémenter, comme on le verra.
Sources de magnésium dans les aquariums marins
- Sels synthétiques : les sels contiennent toujours du Mg. pour autant, leur dosage n’est pas le même : certains sont déficients quand d’autres dépassent le standard de l’eau de mer naturelle.
- Supplémentation Réacteur à calcaire RAC : Les différences de taux dans les sédiments expliquent les teneurs variables dans les substrats ARM sédimentaires utilisés.
Il en est de même du carbonate de calcium synthétique (Cacialith, Korlith..) contenant des taux variables même si le taux est plus faible < 0,5 %. Les branches de coraux en RAC (fingers…) apportent egalement une part de Mg, au maximum 4 % de Mg du squelette dissout. Cet apport peut être suffisant, ou pas selon la densité et les espèces de calcificateurs du bac. - Supplémentation Réacteur à hydroxyde RAH : présence dans certains hydroxydes de calcium utilisés dans les réacteurs à hydroxyde de calcium (RAH). La quantité réellement dissoute est variable.
- Suppléments de calcium synthétique : certains carbonates de calcium contiennent du magnésium, en quantité variable, au stade d’impuretés ou intentionnellement ajouté par les fabricants. Cet apport en quantité indéterminée peut convenir au bac, ou pas.
- Nourriture pour poissons : le magnésium est présent dans de nombreux aliments, à des concentrations parfois élevées, sans que ces apports aient un impact significatif.
- Supplémentations ciblées : les kits de supplémentations multi composants permettent des apports de manière hasardeuse; les apports spécifiques de l’élément Mg via certaines molécules permet de mieux répondre au besoin.
Consommations du magnésium dans l’aquarium
La principale consommation du magnésium relève de la coprécipitation avec le carbonate de calcium. Dans une moindre mesure l’hydroxyde de calcium, utilisé dans le réacteur à hydroxyde (RAH) peut former avec le magnésium, de l’hydroxyde de magnésium et du carbonate de magnésium pouvant précipiter à pH élevé en sortie du RAH. Le réacteur à calcaire conduit au même appauvrissement. Sur le long terme il se produit une carence si le RAH ou le RAC est utilisé comme seul moyen de supplémenter en CaCO3, surtout si les changements d’eau sont éloignés.
Maintenir le magnésium en aquarium
Mesurer le magnésium
Les apports et la consommation de magnésium diffèrent d’un aquarium à l’autre. Même si l’observation renseigne déjà sur la situation,
il est indispensable d’en mesurer régulièrement le taux,
on l’a vu, pour assurer les métabolismes des animaux et pour le maintien des taux de calcium Ca et de carbonates KH. Compte tenu de son impact, il convient de toujours ajuster le magnésium à niveau avant celui du calcium.
Le commerce propose plusieurs tests colorimétriques (Tridacna, Salifert, Tropic marin, JBL, Seachem…). Afin d’éliminer les risques de lecture et d’interprétation, privilégier ceux qui donnent directement le taux de Mg en mg/l, plutôt que d’autres nécessitant un calcul à partir d’une mesure conjointe Ca-Mg et des conversions d’unités. Une analyse type ICP permet de connaitre la concentration de magnésium avec plus de précision.
Le taux acceptable se situe entre 1250 et 1350 mg/l sans jamais être en dessous de 1000 mg/l (risque de chute du Ca et KH) ni dépasser 1600 mg/l.
Viser la concentration naturelle de l’eau eau de mer 1285 ppm dans une plage de 1250 à 1350 ppm.
Ajuster le taux de magnésium
Le tableau précise les conditions et les risques d’une dérive ainsi que les actions à mener si besoin.
Mg < 1100 mg/l c’est le plus grand risque :
- Précipitation du calcium et des carbonates quand leur taux est élevé. Présence d’un voile blanchâtre de précipités sur les décors, eau vitreuse, voire laiteuse.
- Le taux de calcium ne monte pas < 300 mg/l .
Mg > 1600 mg/l
Cette limite est définie empiriquement, on ne connait pas clairement l’impact d’un taux élevé. Fauna marin estime qu’il existe un risque de déséquilibre chimique du calcium.
Nota : Des taux importants >1800 mg/l suggérés dans la lutte contre les algues (Bryopsis…) ne sont pas recommandés.
- Eclaircissement des coraux.
- Desquamation des tissus à la base des SPS
- Couleur fade des Discosomas.
- Polypes des coraux mous rétractés.
- Antennes des crevettes non rectilignes.
- Corallines sans pourtour clair de croissance, fades.
- Croissance stagne : bivalves, gorgones, etc…
Fauna marin évoque :
- Désintégration des tissus des coraux mous.
- Décollement des tissus de SPS.
- Supplémentations trop espacées, insuffisantes
Présence d’espèces consommatrices animales (bivalves…) ou végétales (algues cacaires Halimeda, corallines…) - Précipitation par ‘introduction trop rapide d’hydroxyde de calcium (goutte à goutte).
- Sel pauvre 900 ppm, au lieu de 1200 ppm.
- Test périmé.
- Produits de supplémentation) insuffisament purs.
- Sel synthétique surdosé, mal mélangé.
- Nourriture.
- Substrat (RAC) contenant de la dolomite, marbre, huitres…
Remonter le taux
- Avec des solutions du
commerce dont on ne connaît malheureusement pas la compositio - Avec
une préparation à base de magnésium décrite ci-après.
Réduire le taux
- Laisser descendre naturellement si écart faible ou changement d’eau partiel.
- Forcer le dosage d’eau de chaux pour précipiter le Mg
Préparation pour remonter ponctuellement le magnésium
On utilise une combinaison de sulfate de magnésium (MgSO4) et de chlorure de magnésium (MgCl2). Eviter les formes anhydres, instables, telles que le chlorure de magnésium anhydre (MgCl2). parmi les formes hydratées, les plus facilement disponibles sont le sulfate de magnésium heptahydrate (MgSO47H2O),
et le chlorure de magnésium hexahydrate (MgCl26H2O). Utiliser des produits de qualité pharmaceutique, disponibles en pharmacie ou dans le commerce aquariophile (Tridacna…). L’association de sulfate et de chlorure est préférable, elle permet de ne pas perturber l’équilibre ionique de l’eau. Dans le tableau de dosages, privilégier les options 1 ou 2 plutôt que
3 à 6 données pour information..
Mode d’emploi
- Choisir l’option de traitement.
- Doser le poids des composants avec calculateur magnésium.
- Diluer les poudres en remuant dans environ 4 fois le poids d’eau
distillée, déionisée ou osmosée. Les deux produits
sont facilement solubles, la dilution d’une quantité importante de
chlorure de calcium provoquant un léger dégagement de chaleur
utiliser un récipient qui ne ramolisse pas. - Incorporer dans le bac ou la décantation doucement de préférence
en goutte à goutte dans une zone brassée - Ne pas dépasser la quantité pour remonter 100 mg/l par jour.
- Conservation : la préparation est stable, conservée dans un récipient opaque et fermé. Il est préférable de préparer la
quantité juste nécessaire.
Calculateur magnésium
Supplémenter régulièrement le magnésium
La quantité de magnésium à fournir dans un aquarium ne dépend pas de celle du calcium, mais des organismes hébergés en densité, espèces. Elle peut rester stable, décliner ou augmenter au fil du temps. Les test donnent la conduite à tenir pour supplémenter le magnésium consommé.
Plusieurs modes de supplémentation sont envisageable :
- Changements d’eau réguliers, de 15 jours à mensuels avec un sel correctement dosé. Les fluctuations entre deux apports sont acceptables.
- Changements d’eau étalés, de l’ordre de tous les 2 ou 3 mois : procéder à des rattrapages selon les conseils décrits auparavant.
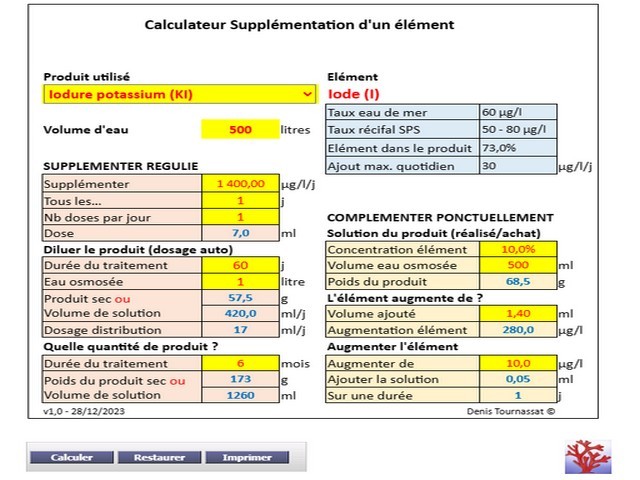
- Changements d’eau très étalés, tous les ans, voire pas du tout : ce choix impose de réaliser régulièrement un bilan chimique via des analyses ICP, d’en déduire la consommation moyenne en mg/l/j. Le Calculateur de supplémentation permet de déterminer les doses et les solutions à préparer. Celles ci sont injectées quotidiennement et automatiquement par pompe doseuse.
En savoir plus
Aquarium Chemistry: Magnesium In Reef Aquaria Randy Holmes-Farley, Advanced aquarist, 2003
Aquarium Chemistry: Magnesium And Strontium In Limewater Randy Holmes-Farley, Advanced aquarist, 2003
Magnésium dans l’aquarium récifal (Ernst Pawlowsky)
Magnesium part I et Part
II (Craig Bingman)Incorporation du magnésium dans les squelettes calcitiques des échinodermes et des éponges hypercalcifiées, Julie HERMANS, 07/2010














Laisser un commentaire