Le premier volet sur les Octocoralliaires nous a permis de mieux connaître l’anatomie des Octocoralliaires, mais ces organismes sessiles, filtreurs, totalement dépendants de leur environnement, ne sont pas tous égaux pour garantir leur survie. Ce chapitre va attarde sur la nutrition qui n’est pas le moindre des processus en jeu en milieu naturel, comme en aquarium. Nous verrons aussi les modes de reproduction ingénieux dont disposent les Octocoralliaires pour assurer la pérennité des espèces.
1 : Classification, anatomie – 2 : Nutrition, reproduction – 3 : Écologie – 4 : Maintenance
1. Comportements alimentaires
Le comportement alimentaire des Octocoralliaires est fortement dépendant de leur anatomie.

1.1. Azooxanthellés : hétérotrophes
Les organismes non photosynthétiques, en l’absence d’endosymbiose, ne peuvent se fournir en carbone via les zooxanthelles. Ils doivent subvenir à tous leurs besoins en carbone et azote, dans les aliments collectés à l’extérieur et déployer d’autres techniques de nutrition : ils doivent capter les particules organiques (plancton, détritus) dans l’eau ou bien absorber des molécules dissoutes. Les Octocoralliaires azooxanthellés sont hétérotrophes.
1.2. Zooxanthellés : mixotrophes
Les coraux zooxanthellés bénéficient de la photosynthèse de leurs algues symbiotiques et une grande majorité des Octocoralliaires en dépendent fortement pour leur nutrition, notamment certains Xeniidés dépourvus de moyen de chasse et disposant d’un appareil digestif réduit. Mais sont-ils autotrophes pour autant ?
Il est prouvé aujourd’hui que la photosynthèse ne peut subvenir à elle seule, à tous les besoins en carbone. En effet, les Octocoralliaires dont la part de zooxanthelles répartie essentiellement en surface est faible en regard de leur biomasse, doivent mettre en œuvre une part des processus de nutrition hétérotrophe comme la capture de particules. Selon leur environnement comme l’éclairement ou la disponibilité en plancton, ils adaptent leur mode de nutrition. Puisqu’ils exploitent les deux types de processus métaboliques, autotrophie et hétérotrophie, les Octocoralliaires zooxanthellés sont mixotrophes.
1.3. Sessiles -> Suspensivores microphages, osmotrophes
Hétérotrophes ou mixotrophes, les Octocoralliaires sont fixés au substrat. Ce caractère sessile les contraint à trouver leur pitance dans leur espace proche ; ils sont totalement dépendants de ce que leur offre leur environnement.
Pour ce, ils exploitent diverses méthodes basées sur la capture de plancton et de particules organiques disponibles dans la colonne d’eau : ce sont des suspensivores (ou filtreurs). Contrairement aux scléractiniaires, les Octocoralliaires disposent d’un système pour générer un courant d’eau chargé de nourriture, ce sont des filtreurs actifs. Les particules capturées sont de petite taille en regard de la taille de leur bouche : ce sont des suspensivores microphages. Selon la nature et la taille des particules, la capture sera basée sur la filtration complétée parfois d’actions de chasse de proies vivantes : ce sont donc aussi, mais dans une faible mesure on le verra, des prédateurs.
Les Octocoralliaires ont également la faculté de puiser directement dans l’eau les nutriments sous forme dissoute, et de les absorber à travers leurs téguments : ils sont osmotrophes.
2. Processus de nutrition
La nutrition consiste en une succession de plusieurs processus (Illustration 1) :
- Ingestion : dans un premier temps, l’animal doit détecter et capter de diverses manières, la nourriture (les aliments) composés de matières organiques, sous différentes formes.
- Digestion : Il s’ensuit plusieurs phases pour fragmenter et décomposer, par voies mécaniques, chimique ou enzymatique, la nourriture ou macronutriments, en unités suffisamment petites (les nutriments ou métabolites), pour passer dans les cellules.
Ces métabolites tels que glucose, acides aminés, acides gras… proviennent de la transformation de macro nutriments : sucres (glucides), protéines et corps gras (lipides) et d’autres plus petits : sels minéraux, antioxydants, oligo éléments… issus de la nourriture et de l’eau environnante.
– Les polysaccharides (glucides) sont transformés en monosaccharides (glucose…)
– Les lipides sont transformés en glycérol et acides gras
– Les protéines sont transformées en acides aminés
– Les acides nucléiques sont transformés en nucléotides
Les glucides et les lipides ont pour fonction principale de fournir de l’énergie ; les protéines jouent un rôle capital dans le fonctionnement de l’organisme (anabolisme). - Absorption et assimilation : à partir des nutriments, les cellules peuvent finalement fabriquer leurs propres molécules et les transporter à travers les tissus, vers les organes vitaux et selon les besoins.
3. Moyens de nutrition dans le milieu naturel
Comme tous les animaux, pour assimiler protéines, sucres, corps gras et les autres éléments nutritifs, les Octocoralliaires mettent en œuvre différents procédés, selon les espèces.
3.1. Rôle des zooxanthelles dans la nutrition
Les zooxanthelles exploitent l’énergie lumineuse pour réaliser la photosynthèse. Cette dernière se déroule en deux phases distinctes et successives :
- Durant la première, dite phase claire parce qu’elle est déclenchée par la lumière, la photosynthèse transforme l’énergie solaire en énergie chimique. Durant la période diurne, l’expansion des colonies augmente l’activité photosynthétique de 30 %.
- Durant la seconde phase obscure, appelée ainsi parce qu’elle ne dépend pas de la lumière, avec l’énergie produite lors de la première phase, la photosynthèse convertit le CO2 au contact du tissu corallien, en différents produits qui sont pour l’essentiel : du glycérol, du glucose, des acides aminés (essentiellement de l’alanine), des vitamines, des hormones et quelques autres acides organiques utilisées par le polype.
Les molécules organiques fabriquées par les zooxanthelles passent à travers la membrane de l’algue, qui leur est perméable, pour rejoindre le cytoplasme des cellules du polype. Les zooxanthelles peuvent fournir jusqu’à 98% des produits de leur photosynthèse à leur hôte. Une partie de la matière organique produite est utilisée comme source de nourriture par le polype.
Mais cette source essentiellement de glucides ne suffit pas, le polype doit trouver les protides et les lipides nécessaires à sa croissance et à son maintien en capturant des proies.
3.2. Capture, ingestion, digestion de particules
Les Octocoralliaires utilisent plusieurs outils, propres aux invertébrés marins microphages, leur permettant de détecter, d’attirer, de capturer, de capter et transporter leur nourriture planctonique avant de pouvoir la digérer.
3.2.1. Déclenchement des captures
D’après les observations, on peut penser que, de manière similaire aux scléractiniaires, des stimuli chimiques déclenchent les réactions de nutrition des Octocoralliaires : extension du polype, mobilité des tentacules, production de mucus, mouvements ciliaires, sortie des entéroïdes… Des analyses sur les scléractiniaires ont permis d’identifier l’efficacité de quelques stimulants chimiques, notamment des acides aminés (proline, arginine, phénylalanine, glycine, aspartate, leucine, glutamate, lysine…) qui agissent à faible dose de manière spécifique. Plus empiriquement, l’efficacité du nuoc-mâm a pu être vérifiée. Les impulsions sont transmises depuis les cellules réceptrices ectodermiques jusqu’au centre musculaire des polypes.
Les cycles d’ouverture et de rétraction des polypes restent encore mal expliqués. Les gorgones symbiotiques des Caraïbes déploient en général leurs polypes et se nourrissent durant la journée, la majorité se contractant la nuit. Sur la Grande barrière, les polypes sont déployés pour moitié le jour et presque tous, ouverts la nuit pour se nourrir activement. Les contractions diurnes peuvent s’expliquer par des courants trop faibles ou au contraire trop importants, une intensité lumineuse trop forte ou le dérangement par des prédateurs.
3.2.2. Piégeage par mucus
On peut noter que ce mucus est également utilisé comme nourriture. Éliminé dans la colonne d’eau, il flotte, en combinaison avec des détritus, sous une forme appelée « neige marine » qui devient à son tour une source alimentaire. Des fabricants commercialisent d’ailleurs une forme reconstituée de cette neige marine.
Les coraux élaborent sur la partie externe de leurs tissus, un mucus hydrophile constitué d’un mélange de protéines et de glucides. Ce mucus est utilisé lors de processus variés comme la protection contre la sédimentation, pour le déparasitage, contre la dessiccation durant leur exondation à marée basse, le stress augmentant sa production. Il est ensuite évacué par des mouvements ciliaires.
Mais ce mucus est également utilisé lors de la nutrition, pour piéger leur nourriture. À la surface de la colonie et selon l’espèce, le mucus piège les particules de zooplancton et/ou de phytoplancton (diatomées) en suspension. Colonisé par une microflore bactérienne, de protozoaires (flagellés, ciliés), il est le siège d’une dégradation et du recyclage en matières bactériennes et organiques ensuite dirigées vers la cavité gastrovasculaire par des mouvements ciliaires. Des études portant sur l’activité antibiotique du mucus de Scléractiniairse contre des espèces invasives, ont permis d’identifier quelques espèces résidentes appartenant aux genres Alteromonas, Agrobacterium, Bacillus, Photobacterium, Phyllobacterium, Halomonas, Exiguobacterium, Peligiobacter.
3.2.3. Panaches tentaculaires
Nombre d’invertébrés suspensivores microphages, surtout lorsqu’ils sont filtreurs passifs, déploient des dispositifs destinés à augmenter leur surface muqueuse dans le courant naturel.
Ainsi, les Octocoralliaires disposent de panaches tentaculaires ou bras et ces derniers sont de plus pourvus de pinnules rapprochés (de l’ordre de 60 à 80 µm chez Dendronephthya). Ce "maillage" ne fixe pas la taille des proies comme on le verra plus loin.
3.2.4. Immobilisation par empoisonnement (cnidocytes)
Même si la présence de zooxanthelles au sein de leurs tissus peut assurer l’essentiel de leur besoins énergétiques, les cnidaires conservent tous un comportement de prédateur et peuvent capturer des proies vivantes au moyen de leurs cnidocytes. Les cnidocytes (ou cnidoblastes) sont des cellules spécialisées, concentrées en différents endroits sous l’épiderme : au bout de tentacules mais aussi près de la bouche, qui servent à la capture de proies et à la protection de l’organisme. Chaque cnidocyte comporte une capsule (cnidocyste) en forme d’ampoule de 10 à 50 µm, refermé par un opercule, enfermant un ensemble d’organes urticants (le nématocyste). Ces organes baignant dans un venin, sont constitués d’un filament, enroulé autour d’un dard invaginé vers le centre de la capsule portant de petits crochets : les stylets.
La présence d’une proie ou d’un environnement chimique stimule un cil sensoriel (cnidocil). Lors de l’excitation du cnidocil, le nématocyste est expulsé par gradient de pression : il stocke dans sa capsule une grande quantité d’ions calcium qui vont être envoyés dans le cytoplasme du cnidocyte. L’augmentation de la concentration en ions calcium dans le cnidocyte crée une pression osmotique qui va causer une entrée d’eau dans la cellule. Cette augmentation du volume d’eau dans le cytoplasme provoque l’expulsion du nématocyste en quelques millisecondes. Le nématocyste libéré, se plante dans sa proie et s’accroche au moyen de stylets, pour injecter son venin et la paralyser. Les cnidocystes à usage unique seront remplacés. L’usage et le remplacement des cnidocytes exigent une dépense d’énergie, aussi. Ceci lié au fait que le cnidaire ne doit pas se piquer, un système de chémorécepteur analyse la proie et le contenu chimique de son épiderme pour déployer les nématocystes seulement si nécessaire et en nombre suffisant.


La majorité des Octocoralliaires dispose de cnidocytes mais leur structure est plus simple, ils sont moins nombreux et leurs nématocystes sont beaucoup moins efficaces (incapables de pénétrer la peau humaine) que ceux des cnidaires à grands polypes tels que les anémones ou les méduses. Ils sont dédiés à la paralysie de petites proies zooplanctoniques vivantes, lentes ou blessées comme les larves de crustacés et de bivalves. Les particules indigestes, les proies trop grandes ou trop actives peuvent être capturées mais vite relâchées. On a pu noter cependant, que des polypes pouvaient s’associer à deux ou trois, pour capturer des proies de plus grande taille. Chez les Octocoralliaires les nématocystes opèrent plutôt en support d’un système de filtration, pour paralyser une proie qui sera ramenée et immédiatement fixée par le mucus, ou pour achever une proie engluée dans ce mucus.
3.2.5. Transport vers la bouche et le pharynx
Les proies et les diverses particules organiques engluées dans le mucus, immobilisées ou non par les nématocystes, peuvent être transportées directement par le tentacule vers la bouche de l’animal.
Si ce n’est pas le cas, la surface tissulaire est couverte de cellules dotées de cils vibratiles animés de battements coordonnés. Leurs mouvements, composés d’une poussée suivie d’une récupération durant laquelle ils reviennent à leur position initiale, créent un mouvement directionnel (voir le chapitre Génération de courants). Ces cils vibratiles, concentrés dans les tentacules et l’environnement buccal portent les aliments vers la bouche puis vers la cavité gastrovasculaire pour y être digérés.
Chez les invertébrés marins, on retrouve ce type de cils vibratiles dans d’autres processus physiologiques comme la création de courants ou l’évacuation de mucus et de particules indésirables.
3.2.6. Prédigestion extracœlentérique par les entéroïdes

Les cnidaires sont pourvus d’une bouche puis d’un pharynx qui débouche dans une cavité gastrique. La surface interne présente des tissus (mésentères), formant des bourrelets mésentéroïdes qui augmentent la surface d’échange. Le mésentère a de nombreuses fonctions : il possède des fibrilles musculaires contribuant à la contraction et l’extension des polypes, il renferme les organes reproducteurs et il intervient aussi dans la digestion. Le bord interne du mésentère dispose de fibres allongées, les filaments mésentériques (entéroïdes), chargées de cnidoblastes et de glandes digestives, qui s’enroulent en rubans dans la partie inférieure. Les filaments mésentériques produisent une excrétion muqueuse abondante chargée de protéases (enzymes qui brisent les liaisons des protéines). Ils peuvent sortir par la bouche permettant la prise de proies, la conquête du terrain en attaquant les tissus d’un voisin envahissant, pour entamer une première digestion extracellulaire. La digestion se poursuit au niveau des filaments mésentériques ventraux et latéraux qui possèdent eux aussi un grand nombre de ces cellules.
3.2.7. Génération de courant
La capture est assurée par les tentacules et dans une moindre mesure par les cnidocytes mais comme on l’a vu plus haut, les Octocoralliaires, sont des filtreurs actifs. Ils sont en mesure de générer un courant d’eau permettant d’attirer les nutriments issus de leur environnement très proche et d’assurer leur circulation interne, jusqu’au rejet des déchets. Cette relative autonomie ne simplifie pas pour autant le système de maintenance aquariophile puisqu’il faut assurer, comme pour les filtreurs passifs, un brassage général de l’aquarium permettant l’apport des nutriments et plus globalement de tous les éléments particulaires ou solubles nécessaires à leur développement, jusque à proximité de l’animal.
3.2.7.1. Siphonoglyphe
Les polypes autozoïdes des Octocoralliaires sont également appelés gastrozoïdes et pour cause ! Comme on l’a vu dans l’article Octocoralliaires 1, ils sont pourvus d’une gouttière, le siphonoglyphe, absente chez les scléractiniaires, qui prend naissance à la bouche, se prolonge le long du pharynx jusqu’à la cavité gastrique. Ce siphonoglyphe est pourvu de cils générant un courant inhalant. La proie est rapidement triée, rejetée ou rapidement acceptée traversant alors le pharynx en quelques minutes.
3.2.7.2. Courant ciliaire

Les cils sont des excroissances en forme de poils plus ou moins long, présents en nombre et couvrant la surface de la membrane externe des cellules. Leurs battements dans les siphonoglyphes, provoquent un mouvement d’eau. Ils se présentent en rangs ; le cil se raidit et se courbe à sa base pour donner un coup de fouet dans le plan de la rangée. Ce mouvement produit une impulsion qui commence en un point et se propage sur le reste de la surface comme une vague. Le cil devient ensuite flasque, il quitte le plan de mouvement pour se coucher sur le côté, sans résistance à l’eau et retrouve sa position initiale. La direction de battement peut être inversée à tout moment. Ainsi, les cils ont un mouvement ondulatoire, coordonné. Le mouvement engendré par les cils est parallèle à la surface de la membrane. Ils transportent ainsi les particules de nourriture vers les organes de digestion (bouche, estomac…) et contribuent à rejeter les particules indésirables, les déchets.
3.2.8. Digestion extracellulaire, intracellulaire
La proie triée par le polype : rejetée ou acceptée, traverse le pharynx en quelques minutes. La présence de proies dans la cavité gastrovasculaire stimule les cellules glandulaires (cellules caliciformes) pour la sécrétion d’enzymes (protéases). A ce stade, les enzymes fragmentent les proies trop grosses pour les cellules digestives et amorcent une première digestion extracellulaire. Il s’ensuit une digestion intracellulaire à l’intérieur des cloisons radiaires (mésentères) de la cavité gastrique qui en augmentent notablement la surface. Ces dernières sont bordées d’entéroïdes dont les filaments mésentériques ventraux et latéraux, riches en cellules digestives et d’enzymes, phagocytent et terminent la digestion. L’intercommunication des cavités gastriques des différents polypes, par le réseau de canaux du cœnosarque (solenia) permet à la colonie de bénéficier de la capture d’un individu.
Selon les espèces et/ou leurs besoins, les modes de nutrition autotrophie/hétérotrophie évoluent et s’équilibrent. Ainsi il existe une relation inversement proportionnelle entre le nombre des zooxanthelles et le développement des filaments mésentériques ventraux et latéraux en termes de surface et de quantité de cellules glandulaires hébergées. Par exemple, les filaments mésentériques de Lobophytum sp. contiennent un grand nombre de cellules glandulaires et seulement quelques zooxanthelles, à contrario Silunaria sp. possède de très petits filaments mésentériques en petit nombre, voire pas du tout ; ses cellules glandulaires sont rares et les zooxanthelles très nombreuses.
3.2.9. Absorption, excrétion
L’absorption se produit au niveau des cellules digestives des mésentéroïdes. Les nutriments assimilés diffusent de cellule à cellule selon des mécanismes complexes et encore mal identifiés, à l’échelle moléculaire.
L’excrétion se fait également au niveau des mésentéroïdes de la cavité digestive. Le courant exhalant entretenu par les filaments mésentériques permet d’évacuer les déchets inattaqués et les composés phosphatés et ammoniacaux issus du métabolisme. Ils sont ensuite évacués par le courant ciliaire exhalant généré par les filaments mésentériques puis rejetés au niveau de la bouche.
4. Sources nutritives dans le milieu naturel
4.1. Photosynthèse : des zooxanthellés aux azooxanthellés
Les nutriments se font rares dans certaines eaux tropicales. Dans les faibles profondeurs, les coraux hébergent des zooxanthelles permettant de compléter leur régime alimentaire : les zooxanthelles transforment au moyen de l’énergie lumineuse, les molécules inorganiques (carbone, azote, phosphore) en molécules organiques directement assimilables par les tissus du corail (glucose, glycérol, acides gras, triglycérides, des acides aminés simples et quelques éléments traces, vitamines…). De rares espèces comme les Xeniidés, dépourvus de cnidocytes et dont l’appareil digestif est réduit, sont très dépendantes des zooxanthelles.
En général, du fait de la biomasse importante des Octocoralliaires par rapport à leur surface, la production de leurs algues symbiotiques est faible comparée à celle des Scléractiniaires symbiotiques. D’autre part, contrariés par les dérangements environnementaux (courants, lumière excessive, sédiments…), leurs polypes ont des cycles d’ouverture et de contraction qui ne correspondent pas exactement à ceux de la lumière du jour. Contrairement aux Scléractiniares, leurs besoins respiratoires, en relation avec l’importance de leur biomasse, sont finalement rarement totalement atteints du fait de la seule photosynthèse. Ils doivent donc trouver ailleurs ce que les algues ne leur fournissent pas ou insuffisamment : azote, phosphore, quelques éléments traces (fer, vitamines…). Ainsi, les Octocoralliaires, toujours peu zooxanthellés (mixotrophes) ou azooxanthellées (hétérotrophes), doivent exploiter d’autres sources nutritives détaillées ci-après.
4.2. Matières dissoutes, organiques (MOD) et non organiques
4.2.1. Matières organiques dissoutes (MOD)
La matière organique est l’ensemble de ces macromolécules parfois complexes et difficiles à identifier dans le milieu marin, provenant de la dégradation de débris animaux et végétaux ainsi que de la production primaire du phytoplancton ou des coraux. Les concentrations océaniques sont faibles et augmentent au niveau du récif. Les MOD incluent divers éléments tels que l’azote organique dissous (NOD), le carbone organique dissous (COD) ou dans une moindre mesure, le phosphore.
Une part des MOD est agglomérée en matières particulaires, certaines étant assimilables par les tissus. L’absorption fait intervenir des cellules ectodermiques chargées de nombreuses petites excroissances (microvillosités) qui augmentent la surface d’échange. Les matières dissoutes pénètrent la cellule par pinocytose, phagocytées par la membrane cellulaire, puis digérées dans des vésicules au moyen d’enzymes, en composants aptes à être transportés et absorbés par les cellules destinataires. L’importance des MOD dans la nutrition des Octocoralliaires reste encore mal déterminée : certains auteurs estiment que, largement consommés par les bactéries et les algues sur le récif, les nutriments dissous sont disponibles seulement à l’état de traces et qu’ils interviennent peu dans la nutrition des Octocoralliaires. D’autres pensent qu’elle n’est pas négligeable, les coraux savent d’aille urs bien détecter la présence d’acides aminés (glycine, alanine, glutamate), manifestée par le déploiement de leurs polypes, le gonflement de leur cœnenchyme et des tissus de leur cavité gastrovasculaire. Les MOD trouvent probablement plus d’intérêt chez les espèces profondes ou celles qui ne profitent pas d’une symbiose avec les zooxanthelles.
4.2.2. Matières non organiques dissoutes
Les matières non organiques absorbées sont des macroéléments (calcium, magnésium, potassium), des bicarbonates, des gaz (O2, CO2) et des oligo-éléments. Les macroéléments jouent un rôle important dans la calcification. Les oligo-éléments comme les halogènes (iode), l’azote (ammonium NH4+ et nitrates NO3−), le phosphore, les métaux (fer, zinc, aluminium…), disponibles dans l’eau de mer en infimes concentrations, sont indispensables à la vie. Certes, les Octocoralliaires ne sont pas hermatypiques et leurs besoins pour la calcification sont faibles, mais ils sont réels.
4.3. Matières organiques particulaires (MOP) vivantes
Production primaire, production secondaire
Production primaire : c’est la production par photosynthèse (la lumière est l’énergie primaire). Elle est la première étape de la chaîne alimentaire. Les végétaux chlorophylliens sont en effet capables de synthétiser de la matière organique, ils sont les producteurs primaires. En mer, ce sont le plancton végétal et les algues telles que les zooxanthelles des coraux.
Production secondaire : elle provient de la transformation de matière organique existante, végétale ou animale. Les consommateurs de phytoplancton, végétariens (zooplancton, petits crustacés, larves de coquillages et de poissons…) sont des producteurs secondaires et nourrissent les animaux carnivores (zooplancton carnivore, poissons, mammifères marins).
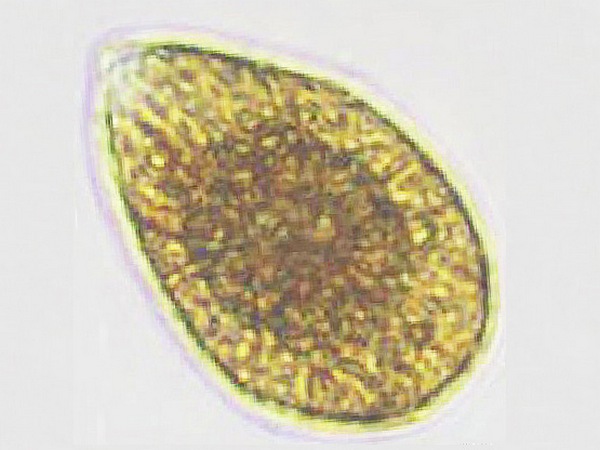
Le plancton est la composante vivante des MOP. Il regroupe un nombre immense d’organismes (illustration 14), classés selon leur taille, en femto, pico, nano, micro, méso et mégaplancton. La nourriture des Octocoralliaires se compose essentiellement de petits organismes planctoniques, depuis les plus petits composant le bactérioplancton, essentiellement du picoplancton, mais aussi de microplancton sous forme de phytoplancton et de zooplancton. S’agissant d’organismes de petites tailles et la biomasse des Octocoralliaires étant parfois importante, leur alimentation peut occuper de longues périodes durant la journée.
4.3.1. Virioplancton
On ne sait pas grand-chose sur l’alimentation de virus par les Octocoralliaires. Retenons qu’il intervient au moins indirectement puisqu’il affecte de manière conséquente l’évolution qualitative et quantitative des populations bactériennes.
4.3.2. Bactérioplancton
Le bactérioplancton de 0,2 à 10 µm, forme l’essentiel du picoplancton et une partie du nanoplancton. Dans les écosystèmes marins, la biomasse bactérienne est énorme, bien plus importante que celle du phytoplancton. Les bactéries hétérotrophes sont des compétiteurs efficaces du phytoplancton pour les éléments nutritifs. En ce qui concerne le carbone, le bactérioplancton constitue la biomasse dominante
dans les eaux récifales à caractère oligotrophe et comme les bactéries présentent des rapports C/N et C/P plus
faibles que ceux du phytoplancton, cette dominance
est donc encore accrue en termes d’azote et de phosphore. Ainsi, dans les eaux faiblement pourvues en azote il peut représenter la quasi-totalité des ressources.
Le rôle du bactérioplancton dans les processus écologiques des récifs et dans celui de la chaîne alimentaire comme source nutritive, s’avère plus important que ce que l’on imaginait il y a quelques années. Il est établi que les abondances bactériennes décroissent lors de leur passage au-dessus du récif, ce qui dénote une forte consommation et que le bactérioplancton tire profit de la matière organique produite par les organismes benthiques. Les progrès effectués dans l’identification des bactéries et la détermination de leur taux de croissance, ont permis de réévaluer le rôle du bactérioplancton dans les flux de matière organique. C’est le concept de "boucle microbienne" dont tirent profit les habitants du récif.
C’est le processus en boucle mettant en œuvre les bactéries hétérotrophes dans les flux de matières organiques au sein de la colonne d’eau.

- D’une part, les bactéries transforment en biomasse les matières organiques dissoutes MOD issues des producteurs primaires (algues, bactéries photosynthétiques, coraux…) :
la MOD produite par l’exsudation du phytoplancton et les déjections du zooplancton phytophage (brisures de phytoplancton, excrétions, pelotes fécales) est consommée par les bactéries hétérotrophes. Cette biomasse bactérienne est elle-même consommée par le nano zooplancton hétérotrophe bactérivore (Protistes : Flagellés et Ciliés). Ce dernier, consommé par le mésoplancton (Copépodes…), la biomasse devient finalement consommable par les maillons supérieurs de la chaîne trophique, au lieu de couler et de s’accumuler dans les sédiments organiques. Cette transformation peut être importante et, notamment dans les écosystèmes recevant des apports externes, dépasser la production primaire du phytoplancton. - D’autre part, les bactéries régénèrent des éléments minéraux : leurs rapports cellulaires C/N et C/P étant relativement bas, elles ne libèrent généralement pas les éléments N et P, mais consommées par les protistes (flagellés et dans une moindre mesure par les ciliés) qui libèrent ces éléments, elles participent ainsi à la régénération des éléments nutritifs (ammonium, phosphore) provenant de la matière organique détritique. Les éléments minéraux libérés de la matière organique peuvent ainsi connaître une deuxième vie dans la couche euphotique (éclairée) et servir à produire, selon les écosystèmes, un surcroît de production primaire, dite de régénération.
Les espèces bactériennes sont assez ciblées selon leur niche nourricière (colonne d’eau, sédiments, mucus corallien…) mais la capacité de régénération des populations bactériennes est telle, qu’elle leur permet de s’adapter rapidement aux fluctuations de MOD (temporelle ou spatiale). Si, comme on l’a vu, la consommation par les protistes dans la colonne d’eau revêt un caractère essentiel, le taux de bactérioplancton décroit fortement (de 40 à 70 %) vers l’aval du récif, ce qui laisse suggérer une prédation bien plus importante par le benthos notamment par les organismes filtreurs.
La consommation de bactéries par les divers organismes benthiques (polychètes, éponges, ascidies, huîtres, coraux…) est encore mal cernée. Elle représenterait globalement de 1 à 9 % de leur besoins quotidiens pour l’ensemble de la faune benthique et avoisinerait de 95 à 99 % pour les éponges. Le taux de bactérioplancton est important dans les sédiments et relativement stable dans les eaux, qu’elles soient chargées ou plus pauvres. Sa diversité est par contre plus importante dans ces dernières. De nombreuses bactéries sont ingérées, fixées aux éléments détritiques ou au phytoplancton (ce qui permet aujourd’hui de relativiser l’importance nutritionnelle accordée au phytoplancton). De fait, en milieu marin, les bactéries s’avèrent être une source essentielle de C et N pour la production de protéines par les animaux consommateurs de phytoplancton ou les consommateurs secondaires. Parmi ceux-ci, les coraux disposent d’une bonne aptitude à s’adapter en cas de besoin pour consommer les bactéries. Ils capturent les protozoaires bactérivores, piègent les bactéries, en partie directement dans leurs mucosités mais plus surement sous forme de particules nutritives, avec une excellente rentabilité si l’on considère le ratio énergie reçue/dépensée. En fait, les coraux vivent dans et dépendent de cette "soupe bactérienne", même si certaines bactéries sont potentiellement pathogènes.
Pélagique ou concentré à la surface des sédiments comme à l’intérieur des agrégats, le récifaliste ne sait pas mesurer quantitativement ni qualitativement la population bactérienne occupant son système aquariophile. Connaissant son importance, il a tout intérêt à entretenir au mieux cette population, par l’apport de souches, par son alimentation et à la perturber le moins possible avec des traitements ou des produits aux résultats aléatoires.
4.3.3. Phytoplancton, protistes et bactéries autotrophes
Le phytoplancton est constitué de la partie végétale du plancton, des protistes autotrophes, photosynthétiques (les protophytes) comme les dinoflagellés ainsi que des bactéries autotrophes comme les cyanobactéries. Il couvre une partie du picoplancton, tout le nanoplancton et une part de microplancton avec quelques espèces à caractère filamenteux. Un peu moins importante que pour les bactéries, la biomasse représentée par le phytoplancton reste considérable et impacte, elle aussi, le milieu récifal. Comme les bactéries, le phytoplancton réagit rapidement à l’environnement (prédation, éclairement, nutriments…) au point de créer des blooms à l’image des proliférations bactériennes. Ces algues sont présentes dans le milieu naturel et jouent sûrement un rôle dans un milieu captif.

Le phytoplancton est essentiellement consommé par le zooplancton. Les ciliés, les protozoaires et certaines larves d’invertébrés consomment le nanoplancton tandis que les copépodes, amphipodes consomment le microplancton, de plus grande taille. Cette consommation évolue selon des cycles saisonniers mais également selon un cycle quotidien. En effet, le taux mesuré de phytoplancton baisse la nuit en relation avec la consommation nocturne du zooplancton.
Les Octocoralliaires se nourrissent essentiellement du phytoplancton dont la taille est inférieure à 20 µm. Les tests montrent que les Octocoralliaires consomment des protistes Dynophyta (Dinoflagellés), des microalgues Bacillariophyta (diatomées) comme Chaetoceros et d’autres comme Nannochloropsis, Isochrysis et Tetraselmis spp. Dans nos aquariums, le phytoplancton est présent, en quantité difficile à apprécier, non négligeable quand on procède au nettoyage des vitres, sauf quand il n’est pas rapidement éliminé par l’écumeur. Quels sont les besoins réels ? Cela reste encore flou et difficile à apprécier, mais ils sont sûrement importants. Encore faut-il déterminer la quantité et la régularité des distributions selon les consommateurs de l’aquarium. L’idéal serait de proposer une gamme similaire en taille, à celle du milieu naturel. La disponibilité sur le marché ne permet malheureusement pas de répondre aux besoins de tous les consommateurs. On doit saluer les efforts de certains éleveurs pour conserver et proposer les souches vivantes en leur possession.
4.3.4. Zooplancton et protistes hétérotrophes
Le zooplancton est constitué des espèces animales du plancton. Dans la nature, la production de zooplancton évolue selon la disponibilité de leur nourriture constituée du phytoplancton. On constate une recrudescence importante l’été ainsi qu’en périodes nocturnes quand le taux de micro crustacés et de larves d’invertébrés augmente. Ceci explique en partie l’ouverture et le gonflement de polypes des coraux, la nuit, en quête de nourriture. Comme on le verra plus loin, les polypes savent s’adapter à la concentration de cette nourriture qui varie suivant d’autres critères environnementaux comme le courant.
Les Octocoralliaires sont de piètres chasseurs, du fait de la faible efficacité de leurs cnidoblastes. Ils consomment essentiellement du plancton peu actif, de taille inférieures à 20 µm et jusqu’à 300 µm selon les espèces, constitué de micro crustacés et de leur larves (copépodes, ostracodes, amphipodes) ainsi que des larves de bivalves, de gastéropodes, tintinnides (ciliés), polychètes… Malheureusement, nombre de ces espèces ne sont pas disponibles dans un aquarium. La nourriture vivante de substitution constituée de copépodes ou de nauplii d’artémia est, selon leur régime alimentaire, bien acceptés par les Octocoralliaires.
Comme indiqué plus haut, ce zooplancton inclut également des protistes hétérotrophes (protozoaires) qui constituent les proies les plus petites et forment l’essentiel du nano-zooplancton, de 2 à 20 µm. De constitution très simple, les protozoaires se nourrissent de particules organiques, de bactéries, d’autres protozoaires ou d’animaux microscopiques. Les espèces qui nous intéressent sont représentées par les formes vivant à l’état libre dans des milieux aqueux. Il a été établi que des Octocoralliaires se nourrissent de protozoaires flagellés comme source non négligeable d’azote, indispensable à leur croissance. Les ciliés (infusoires) du genre Euplotes élevés par certains aquariophiles dans le cadre de leur aquaculture devraient convenir.
4.3.5. Autres invertébrés
Les Octocoralliaires, à l’instar des scléractiniaires, sont en mesure de se nourrir des invertébrés avoisinants d’une autre espèce ou de la même espèce, Ce mécanisme de prédigestion extracœlentérique comme on l’a vu plus haut, permet de lutter contre la concurrence pour l’occupation du territoire.
4.3.6. Macro algues benthiques
Des expérimentations ont mis en évidence la capacité de certains coraux à collecter et ingérer, par expulsion de leurs filaments mésentériques, les éléments nutritifs secrétés par les algues et les biofilms superficiels, riches en éléments organiques et en bactéries.
4.4. Matières organiques particulaires (MOP) inertes : détritus et neige marine
Les détritus sont les restes des nourritures non consommées, des excréments, des organismes animaux et végétaux en décomposition et d’autres poussières inorganiques en sustentation. Ils s’agglomèrent en particules exopolymériques transparentes (TEP) de 1 à environ 50 µm. Liés spontanément par un mucus issu de l’exsudation de polysaccharides, produit par le phytoplancton et les bactéries, ils sont très riches en carbone (glucides) fixé lors de la photosynthèse. C’est ce que l’on nomme la neige marine. La production de neige marine est donc liée à celle du phytoplancton.


Cette neige, en partie en suspension étant consommée, par plusieurs organismes : copépodes, protozoaires, coraux et autres animaux filtreurs, elle est ainsi réintroduite dans la chaine alimentaire, mais pas seulement. La neige marine poursuit son agglomération en agrégats plus importants et se dépose sur le fond sous forme de sédiments. Cette couche de matière organique est finalement partiellement minéralisée par les bactéries (bactériobenthos) et convertie en molécules inorganiques telles que le nitrate et le phosphate pour servir de nutriments à d’autres invertébrés, en particulier ceux qui se développent dans les eaux turbides.
Les effets des sédiments ne sont pas toujours positifs. Leur accumulation excessive, bien souvent provoquée par l’activité humaine, sur les invertébrés sessiles peut être désastreuse, jusqu’à la disparition des individus et des récifs. Une forte sédimentation étouffe littéralement le récif en bloquant la lumière, l’absorption de la nourriture et les échanges gazeux.
Les coraux d’une manière générale, sont consommateurs des MOP qui peuvent fournir l’essentiel de leurs besoins en azote et carbone. Les octocoralliaires et les gorgones en particulier, s’avèrent bien accepter cette source de nourriture morte qui nécessite un minimum de dépense énergétique pour la capture par ailleurs pourvue d’une flore bactérienne et d’algues.
En aquariums les MOP sont constituées par les excréments de poissons, le mucus du corail, les restes d’algues, les déjections de vers, les mues de microcrustacés, les restes de nourriture et d’autres débris. Elles sont souvent évacuées par la filtration et l’écumeur et peut-être trop souvent, étant considéré ce qui vient d’être énoncé. Les particules grossières se déposent au fond sous forme de sédiments organiques dont la présence dans un milieu captif reste largement discutée : soit considérés comme une pollution de nature à déstabiliser le système clos ou nécroser les coraux au niveau des zones en prise avec les dépôts et donc, aspiré, soit géré biologiquement au sein d’un sable vivant efficace associé à une flore bactérienne et une faune détritivore adaptées.
5. Reproduction
Les Octocoralliaires disposent de plusieurs modes de reproduction sexuée et asexuée. La stratégie de reproduction se reflète bien souvent dans la manière dont les colonies se sont propagées, ont colonisé ou recolonisé des zones libres. Par exemple, la ponte massive en eau libre des Alcyoniidae permet de coloniser des habitats lointains, le choix adopté par les Xeniidae de procéder sexuellement par incubation de larves ou par reproduction asexuée permet une multiplication rapide mais une colonisation lente des espaces.
5.1. Reproduction asexuée
Filtre de rencontre
C’est l’ensemble des facteurs qui font que deux individus ne vont pas pourvoir se rencontrer. Par exemple, l’émission non synchrone des gamètes rend leur rencontre impossible, elles ne vont pas pouvoir se féconder.
La reproduction asexuée présente certains avantages : elle fait participer l’ensemble des individus d’une colonie, elle présente une grande simplicité par rapport à la reproduction sexuée (en l’absence de production et de filtre de rencontre des gamètes) ; elle produit de nombreux individus de même génération et de même lignée génétique à partir d’un parent : dans un environnement stable et favorable, la croissance de ces individus agrégés est plus rapide. Par contre, elle n’augmente pas la diversité génétique et si elle avait été le seul moyen de reproduction, les récifs ne seraient pas ce qu’ils sont ou ne seraient plus. La majorité des Octocoralliaires peut se reproduire de cette manière asexuée et s’avère en certaines occasions, leur principal mode de reproduction. En milieu captif, c’est le mode de prolifération privilégié par les aquariophiles.
5.1.1. Fragmentation de colonies
C’est le mode de reproduction le plus fréquent. Il se produit de différentes manières :
- Auto étranglement d’un rameau de quelques polypes ; le fragment tombe sur le substrat et s’y fixe rapidement (Dendronephthya, Junceela fragilis, Sarcophyton…). La colonie fille s’enracine par des filaments depuis la base ou adhère, elle se consolidera avec la croissance.
- Segmentation de l’extrémité d’une branche ; le corail favorise la croissance d’algues qui croissent autour d’un rameau et le compriment jusqu’à ce qu’il se détache (Alcyonium, Lemnalia, Nephtea, Capnella…). Le segment, parfois gonflé, se déposera plus loin avec le courant.
- Fragmentation subie : due à des prédateurs, à des perturbations naturelles (tempêtes, cyclone) ou anthropique (amarrage, engin de pêche). Les dégâts peuvent être importants mais le développement de nouvelles colonies l’est tout autant. Le corail (Sarcophyton) peut même générer des nécroses pour accélérer le processus.
- Séparation spontanée : des polypes individuels se détachent spontanément et sont entrainés par le courant (Xenia, Anthelia). La fragmentation se produit chez certaines espèces (Xenia), au niveau du pédoncule colonial.
- Stolonisation : Certaines espèces (Efflatounaria) développent des cordons rubanés ou cylindriques (stolons), à leur base ou sous forme de branches stériles de trois à cinq fois la taille de la colonie, qui se fixent au substrat. La colonie mère transfère une partie de son corps via le stolon pour former une colonie fille avant de se détacher. Le stolon se résorbe ensuite et disparait, laissant deux colonies indépendantes. D’autres espèces (Clavularia), forment à leur base un stolon qui génère des bourgeons (stolon prolifère), à l’origine d’un nouveau polype. Le stolon reste fixé au substrat formant des connexions horizontales entre les polypes.


5.1.2. Bourgeonnement
Il se produit à la base du pédoncule ou juste sous le capitule du spécimen (Sarcophyton, Sinularia). Si le bourgeonnement a lieu à la base d’une petite colonie, fille et mère peuvent se développer ensemble. S’il s’agit d’une grande colonie, les filles restent chétives car ombragées par leur mère. Le bourgeon peut se séparer et se fixer au substrat pour former une petite colonie.
5.1.3. Scissiparité
On peut avoir une division transversale avec séparation du capitule et du pédoncule, ou une division longitudinale chez les genres à pédoncule épais (Sarcophyton, Lobophytum) ou branchus (Lemnalia, Nephtea, Cladiella, Xenia et Heteroxenia). Ce phénomène donne naissance à deux colonies de taille équivalente.
5.1.4. Lacération du pied
Certains Octocoralliaires (Xenia, Cladiella, Nephtea) se déplacent sur le substrat en rampant. Au cours de leur mouvement, une partie du tissu de la base peut se détacher de la colonie et donner naissance à un nouveau spécimen. Les lacérations issues de prédations ou de blessures aboutissent, suivant le même principe, à la multiplication de la colonie.



5.2. Reproduction sexuée
5.2.1. Principe
Les organes reproducteurs (gonades) des polypes, les ovaires chez la femelle et les spermaties chez le mâle, produisent des cellules reproductrices (gamètes) : les ovocytes qui évoluent à leur stade mature en ovules, chez la femelle et les spermatozoïdes, chez le mâle. La fécondation des ovules par les spermatozoïdes aboutit à l’union de ces deux gamètes en une cellule-œuf (zygote). Il se développe alors un embryon lequel, après des divisions cellulaires successives, forme une larve (planula), en mesure de nager librement. Cette dernière, après évolution peut finalement se fixer et se métamorphoser en un polype juvénile possédant à ce stade, toutes les fonctions de l’espèce.
5.2.2. Sexualité des Octocoralliaires
Lorsque des colonies d’une même espèce occupent un territoire, quel que soit le mode de reproduction, sexué ou asexué, chaque colonie de polypes est toujours issue d’un seul polype parent. Tous les descendants disposent donc des caractéristiques de ce parent. Ainsi, les polypes d’une même colonie sont tous : soit mâles, soit femelles, soit hermaphrodites (Illustration 15).
- La majorité des Octocoralliaires est gonochorique (ou dioïque) : La colonie contient uniquement des polypes mâles ou uniquement des polypes femelles.
- Une minorité est hermaphrodite, la colonie produit alors, à la fois des ovocytes et du sperme (hermaphrodisme simultané). Dans ce scénario, les polypes contiennent à la fois des gonades mâles et femelles, c’est le cas d’Heteroxenia et de Xenia. Selon les espèces, les organes génitaux mâles et femelles sont situés sur des mésentéroïdes séparés ou sur les mêmes mésentéroïdes. Le mode de libération varie selon les espèces mais aussi parfois selon leur taille : ovules et spermatozoïdes peuvent être libérés séparément ou bien ensemble en un paquet qui se disloque rapidement avant que l’ovule soit fécondable.
Les coraux, atteignent leur maturité sexuelle après un certain temps qui peut dépendre de l’âge de la colonie, par exemple un an pour les Xenia tandis que les colonies de femelles Sarcophyton spp. en nécessitent dix. Pour d’autres, ce serait la taille ou leur surface qui est déterminante ou encore la densité de polypes. Ceci dit, les conditions étant remplies, il n’est pas sûr que la colonie devienne féconde. La production de gamètes et la ponte nécessitent une grande dépense d’énergie, il est nécessaire que le corail soit en bonne santé et même en mesure de stocker auparavant cette énergie. Dans certains cas, une colonie peut être partiellement féconde, avec des polypes capables de produire des gamètes sur une zone et stériles ailleurs. Cette dépendance à l’énergie explique en partie le caractère saisonnier des périodes de reproduction. En effet, la température, la présence de plancton et la production de zooxanthelles constituent des facteurs importants. D’une manière générale, les pontes ont lieu à des jours et heures (souvent la nuit mais pas toujours) liés à la pleine lune lors des périodes les plus chaudes, mais ceci peut varier d’une région à l’autre et de manière décalée selon les espèces. Le facteur chimique supposé déclencher la ponte au sein du corail, reste actuellement au stade d’hypothèse..
5.2.3. Organes reproducteurs

Les organes génitaux se situent dans des accumulations de tissu gastrodermal, sur les mésentères des polypes. Les ovaires produisent les ovules dont elles prennent la teinte orange et les spermaries ont la blancheur opaque de leurs sacs spermatiques contenant les spermatozoïdes. En général, les gonades se trouvent dans les polypes autozoïdes (Sarcophyton, Lobophytum), chez certaines espèces on les trouve dans les polypes siphonozoïdes (Bathyalcyon robustum, Heteroxenia) alors que les polypes autozoïdes sont stériles et dans de plus rares cas (Minabea robusta), les deux types de polypes hébergent les gonades.
Les sacs spermatiques contiennent de nombreux spermatozoïdes flagellés qui arrivent à maturation après une année. Les ovaires contiennent de un à cinq ovules en moyenne. L’ovule d’environ 0,7 mm, présente un cytoplasme granulaire et un noyau large muni d’un nucleolus excentrique mais à ce stade il n’héberge pas de zooxanthelle. L’étude de certaines espèces montre que le développement des ovules dure jusqu’à deux ans, Il n’est donc pas rare de trouver dans le même polype des ovules de taille différente. Après rupture des différentes membranes qui les entourent, les ovules se détachent des cloisons et se retrouvent libres dans la cavité gastrovasculaire. Chez les espèces à fécondation externe, elles remontent par le pharynx et sont expulsées dans l’eau de mer par la bouche du polype. En cas de fécondation interne, elles restent dans la cavité gastrovasculaire dans l’attente d’un éventuel spermatozoïde.
5.2.4. Modes de reproduction sexuée
Les Octocoralliaires procèdent selon trois modes de reproduction sexuée (Illustration 5). Comme chez tous les Anthozoaires, la planula des Octocoralliaires se transforme directement en polype sans passer par une phase méduse.
5.2.4.1. Diffusion de gamètes en eau libre et fécondation externe (ovipare) (Broadcasting)

C’est le mode le plus fréquent chez les alcyoniidés et certaines gorgones. Il nécessite un frai synchronisé. La ponte a lieu à différents moments de l’année, en principe synchronisée avec le cycle lunaire ou avec la température de l’eau mais les conditions sont encore mal cernées et l’aquariophile ne doit pas espérer provoquer des pontes par le seul effet d’une lampe « clair de lune » au-dessus du bac. Cette diffusion massive dans le courant augmente les chances de fécondation. Simultanément, les individus femelles se plissent, rétractent leurs tentacules et libèrent leurs ovules en pleine eau par leur orifice buccal, tandis que les mâles émettent par paquets, des spermatozoïdes dépourvus de queue et dont la tête est ornée de pointes coniques. Les hermaphrodites simultanés, en général, ne libèrent pas leur œufs et le sperme séparément mais dans des paquets contenant plusieurs centaines d’œufs au milieu de spermatozoïdes. Les spermatozoïdes ayant une durée de vie réduite et sans mobilité en eau de mer, cela permet de les conserver plus longtemps et proches des ovules, flottant en nappes à la surface. Lorsque les poches se rompent, la fécondation peut avoir lieu, avec un meilleur taux de réussite.
5.2.4.2. Fécondation interne et incubation (Brooding)
Dans ce mode de reproduction :
- Soit les colonies sont gonochoriques, alors le sperme (jamais les ovules), est répandu dans l’eau, bien souvent quelques heures après le coucher du soleil au printemps et en été, généralement après la nouvelle lune. De manière aléatoire, les spermatozoïdes, attirés par des phéromones, rejoignent la cavité gastrovasculaire des polypes femelle pour féconder une faible quantité d’ovules.
- Soit il s’agit d’une colonie hermaphrodite, les gamètes mâles et femelles s’autofécondent alors à l’intérieur du polype. L’incubation des œufs fécondés (zygotes) se déroule ensuite suivant deux cas en fonction des espèces :
- Incubation interne de larves (vivipare)
Les zygotes forment des planulas au sein du polype qui migrent ensuite dans des chambres de la mésoglée pour se développer. Quelques jours à quelques semaines plus tard, les larves sont expulsées lorsqu’elles sont proches de leur métamorphose en polype. Les espèces de la famille Xeniidae et la majorité des gorgones sont des incubateurs internes. - Incubation externe des œufs (ovipare)
Les œufs zygotes sont expulsés du polype, ils adhèrent à ses flancs dans des poches muqueuses. Ces sacs d’incubation sont à flottabilité négative et peuvent également s’établir sur la surface de la colonie ou à quelques mètres. Les larves s’y développent jusqu’à leur libération, quelques heures après le crépuscule. C’est le cas des espèces des genres Clavularia, Briareum, Rhytisma, Efflatounaria et certaines gorgones.
- Incubation interne de larves (vivipare)








5.2.5. Étapes de reproduction
5.2.5.1. Fécondation, développement embryonnaire et larvaire
On l’a vu, selon les espèces, le développement débute au sein du polype ou dans le milieu extérieur. Dans le cas de diffusion, la fertilisation des ovules se produit quelques heures après la ponte. Chez les incubateurs, L’ovule est entouré des spermatozoïdes, puis est fécondé par l’un d’entre eux. C’est le point de départ du développement embryonnaire. Chez certaines espèces, les zooxanthelles pénètrent dans l’œuf juste après la fécondation. Ces algues ne sont pas digérées mais incluses dans le tissu du polype pour débuter une vie de symbiote.
L’œuf fécondé subit une segmentation superficielle. Après environ 24 heures, le développement embryonnaire aboutit à une dizaine de cellules (stade morula). On observe la formation d’une vésicule non ciliée la blastosphère (stade blastula), ayant une large cavité centrale composée de un puis deux feuillets (ectoderme et endoderme). Le renversement d’un feuillet aboutit à l’ouverture de la vésicule qui deviendra la future cavité gastrique (stade gastrula). La mésoglée se différencie entre l’ectoderme et l’endoderme, les flagelles se forment et ainsi l’embryon se transforme en larve. 48 heures après la fécondation, la surface de l’embryon est ondulée et la larve (pré-planula) apparaît pour évoluer jusqu’au quatrième jour, en planula sphérique, onduleuse et ciliée en mesure de nager librement.
5.2.5.2. Planulation

On désigne sous ce nom l’expulsion des jeunes larves dans le milieu extérieur. Après incubation interne. La planula nage dans le lumen du polype pendant deux à quatre semaines puis est rejetée, le plus souvent par la cavité buccale mais, chez certaines espèces, on observe la formation de pores transitoires permettant l’évacuation des larves. Le nombre de larves expulsées par unité de temps est variable selon les espèces. La période de planulation est sous contrôle génétique, mais elle dépend également de facteurs externes ; elle peut donc varier pour une même espèce. Selon les espèces, elle est en relation ou non avec les phases lunaires. Si elle est en relation avec la lune, elle se produira de façon périodique ; dans le cas contraire, elle aura lieu de façon continue sur des intervalles de temps plus ou moins longs en fonction des espèces. Le contrôle lunaire s’exerce par l’intermédiaire des marées : la pression dans l’eau (qui varie en fonction de l’alignement du soleil et de la lune avec la terre) agit sur la maturation des gonades et sur l’expulsion des planula. La lune exerce aussi son action grâce à la lumière qu’elle réfléchit.
La planula incubée, après son expulsion du polype, reste parfois quelques minutes sans bouger, puis grâce à ses flagelles, nage jusqu’à la surface de l’eau. Elle avance de manière saccadée grâce à l’alternance de contractions et d’extensions. Les planula incubées sont assez matures pour se métamorphoser rapidement en polypes juvéniles. Elles sont généralement plus grandes que les larves produites par diffusion massive et contiennent une souche de zooxanthelles transmis par le parent. La durée de la vie larvaire varie avec les espèces. Les planulas incubées sont potentiellement capables de se disperser loin avec l’énergie fournies par leurs zooxanthelles, mais dans la pratique, leur vie est réduite, elles ne se dispersent pas longtemps ni très loin et se fixent dans l’environnement du parent.
Dans le cas d’une diffusion massive (broadcaster), les larves se développent dans le plancton pélagique durant quelques jours à mois, sur des distances pouvant avoisiner les cent kilomètres, selon l’espèce et la vitesse d’acquisition des souches de zooxanthelles.
5.2.5.3. Fixation de la larve
Plus tard, parfois d’après certains signaux environnementaux, la larve coule vers le fond. Elle choisit le lieu selon le substrat (dureté, rugosité), la profondeur, la lumière, les biofilms bactériens et d’autres micro-organismes, les algues coralliennes… selon la perception de certains indicateurs chimiques, avec une préférence pour les surfaces encroutées de corallines. La planula sécrète une substance muqueuse blanche, adhésive et s’accroche finalement au support par son pôle aboral. la planula a la possibilité de ramper vers des zones plus protégées, lumineuses, plus adaptées à la prolifération de l’espèce;
Dès le premier jour de fixation, les cils de la planula disparaissent et la larve fixée s’aplatit. Son pôle aboral devient le pied du premier polype. Elle devient discoïde Le deuxième jour, La larve se divise, huit extensions verticales apparaissent et on distingue, au sommet de la surface libre, huit petites digitations coniques tentaculaires. Le troisième jour, le polype grandit et il se forme au centre du disque tentaculaire une invagination ectodermique dont la rupture au quatrième jour, forme la bouche. Les jours suivants, le polype grandit et les rangées de pinnules se forment progressivement. La larve est transformée en un polype appelé oozoïte,

A ce stade, certaines espèces commencent à ingérer des zooxanthelles du plancton. Pour les autres, comme on l’a vu plus haut, les gamètes femelles sont pourvues en zooxanthelles juste après la fécondation, avant leur libération en pleine eau.
5.2.5.4. Développement de la colonie
Trois semaines plus tard on assiste à une prolifération par stolon : ce dernier se développe en cercle autour de la base du polype puis engendre un bourgeon qui donne naissance à un deuxième polype dont les septes dorsaux sont voisins de ceux du polype primitif. Un nouveau bourgeon se développe et donne naissance à un autre polype et ainsi de suite, naissent de nouveaux polypes primitifs (zoïdes). Après un premier cercle de bourgeons, un second cercle se créé à l’extérieur du précédent. Il apparait ensuite de nouveaux polypes entre le premier cercle et le polype primitif. Seules quelques espèces d’Octocoralliaires de profondeur ne sont formées que d’un seul polype et restent solitaire.
Ce chapitre se termine sur la reproduction et la propagation des Octocoralliaires. Laissons les colonies s’étendre, nous verrons comment celles-ci évoluent dans leur milieu, dans un prochain chapitre consacré à l’écologie des Octocoralliaires.
Références
- K. Fabricius, P. Alderslade. Soft corals and sea fans – A comprehensive guide to the tropical shallow-water genera of the Central-West Pacific, the Indian Ocean and the Red Sea. Australian Institute of Marine Science, Townsville, Australia. 2001. 264 p
- J. Sprung, J. C. Delbeck. L’aquarium récifal, volume 2. Ricordea Publishing 1999.
- Daniel I. Rubenstein; M. A. R. Koehl.The Mechanisms of Filter Feeding: Some Theoretical Considerations. The American Naturalist, Vol. 111, No. 981. Sept, oct 1997.
- J. Vimal. Physiopathologie des Coraux. Thèse Université Claude-Bernard. Lyon I, mai 2007.
The food of reef, Part1 – Part7 – Reefkeeping, janvier 2003 – avril 2003.. - Shimek R. L. The Reef Aquarium Consequences of Suspension-Feeding as a Way of Life. Reef.org
- Wijgerde T., M.Sc., Houlbrèque F., Ferrier-Pagès C. How Corals Feed. Coralscience.org. 2009. PDF.
- Tim Wijgerde, Ph.D. Feature Article: Coral Feeding: An Overview, Advanced Aquarists, Vol 12. Décembre 2013
Advanced Aquarist. Vol X, décembre 2013 - H. R. Lasker. A Comparison of the Particulate Feeding Abilities of Three Species of Gorgonian Soft Coral. Marine Ecology Progress Series, Vol. 5: 61-67, 1981.
- Kim B. Ritchie. Regulation of microbial populations by coral surface mucus and mucus-associated bacteria. Marine Ecology Progress Series. Vol. 322: 1–14, 2006.
- S. Personnic, S. Duhamel, Y. Bettarel,
T. Sime-Ngando, S. Jacquet. Les virus planctoniques : un compartiment biologique clé
des milieux aquatiques. Courrier de l’environnement de l’INRA n°53, décembre 2006. - J-P. Torréton. Importance du bactérioplancton
dans la transformation et le devenir de la matière organique en milieu corallien. Centre IRD de Nouméa. Océanis, vol. 26 no 3. 2000, p. 389-425. - P. Mollo, A. Noury. Le manuel du plancton. Éditions Charles Léopold Mayer, 2013.
- E. Borneman. Reproduction in Aquarium Corals. Reefkeeping, mai 2003.
- A. Simpson. Reproduction in Octocorals (Subclass Octocorallia): A Review of Published Literature. University of Maine, Darling Marine Center.
- Y. Achituv, E. Benayahu. Polyp dimorphism and functional, sequential hermaphroditism in the soft coral Heteroxenia
fuscescens (Octocorallia). Marine Ecology Progress Series, Vol. 64: 263-269, juillet 1990.
Tous mes remerciements aux auteurs des photos pour leur accord de publication et à mes correcteurs Christian SEITZ, Olivier SOULAT et Jérémie VIDAL DUPIOL, pour leur soutien.
Article publié sur Cap récifal le 01 novembre 2014.













Laisser un commentaire